Genética de la Microangiopatía Trombótica


Por: Dra. Priscila Berenice Villalvazo Osoria
Nefróloga
Universidad Autónoma de Madrid
Consejo Nacional de Ciencia y Tecnología (CONACYT)
La MAT incluye una amplia cantidad de síndromes [1] que se presentan con diversas manifestaciones clínicas que incluyen anemia hemolítica, trombocitopenia y daño orgánico [2]. A nivel renal, la mayoría de las veces causa lesión renal aguda (LRA) que además conlleva una alta morbi-mortalidad, incluyendo enfermedad renal crónica terminal (ERCT) [3].
La clasificación actual describe MAT primaria, dentro de las que se encuentran las adquiridas o hereditarias; MAT secundaria y MAT asociada a infecciones [1] (Figura 1). Se han identificado variantes genéticas en la vía alternativa del complemento y en la vía de la coagulación asociadas a la enfermedad tanto hereditaria como secundaria, [4–6] (Tabla 1). No obstante, el desarrollo de MAT suele ser consecuencia de la combinación de la susceptibilidad genética con factores ambientales activadores de la vía alternativa del complemento [3].

Figura 1. CRE: crisis renal esclerodérmica; FH: factor H; LES: lupus eritematosos sistémico; MAT: microangiopatía trombótica; PTT: púrpura trombocitopénica trombótica; SAC: síndrome antifosfolípidos catastrófico; STEC: Escherichia coli productora de toxina shiga; SHU: síndrome hemolítico urémico; SHUa: síndrome hemolítico urémico atípico; TMO: trasplante de médula ósea; VIH: virus de inmunodeficiencia humana.
¿Cuáles son los genes asociados al desarrollo de MAT?
Existen diversas anormalidades genéticas asociadas a la fisiopatología de la MAT. Algunas variantes genéticas en un gen o la combinación de varias con un ambiente propicio, dan lugar a una MAT congénita que puede presentarse como un Síndrome Hemolítico Urémico atípico (SHUa) (Figura 2a) o Púrpura Trombocitopénica Trombótica (TTP) (Figura 2b). Otras anormalidades genéticas causan alteraciones de la vía alternativa del complemento que dan lugar a un SHUa. En la Tabla 1 se resumen los genes asociados hasta el momento con la MAT [7].
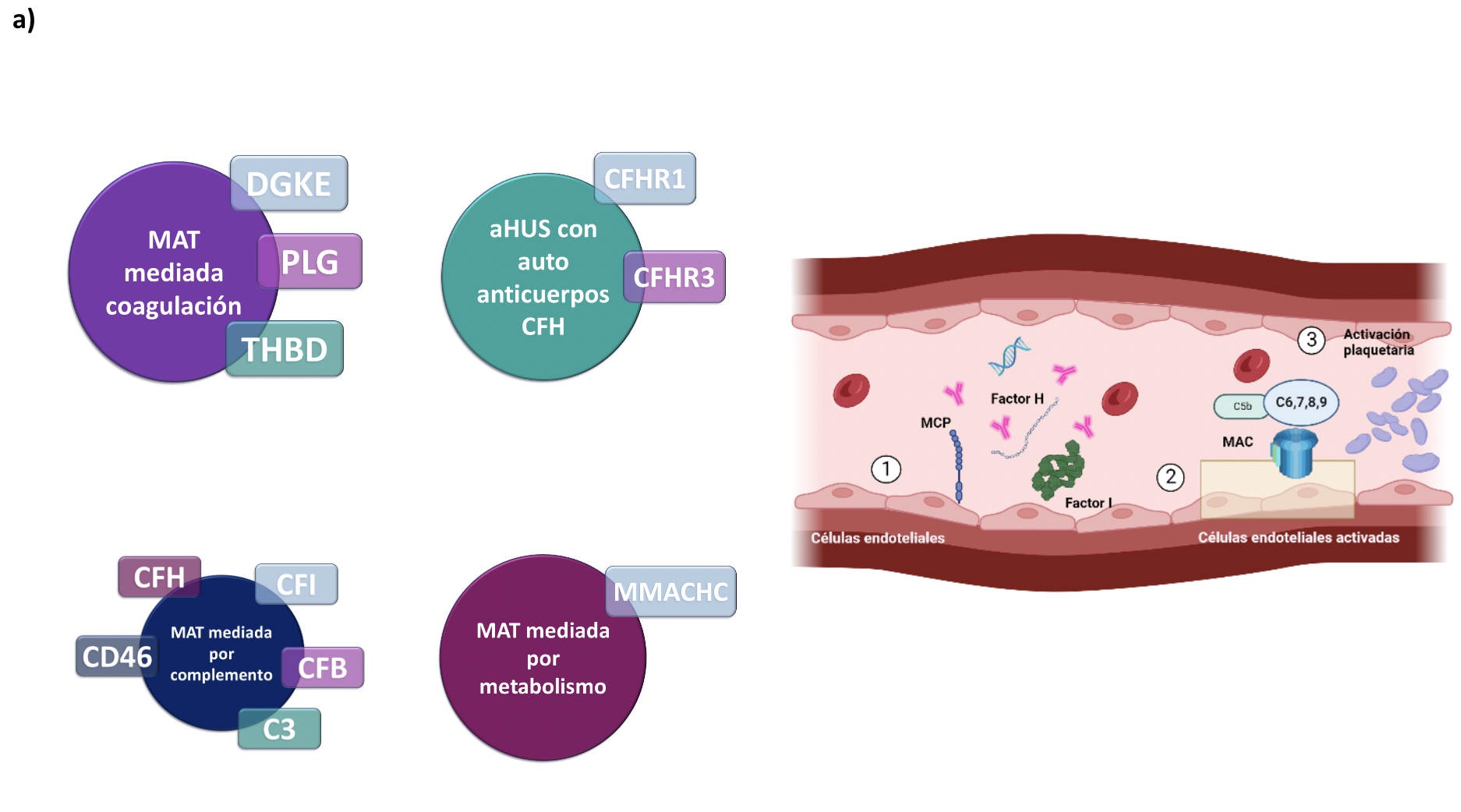
Figura 2a. En el síndrome hemolítico urémico atípico, existe una desregulación de la vía inhibitoria del complemento. (1) Las anormalidades genéticas más comunes están relacionadas con alteración de las proteínas reguladoras del complemento como factor H (CFH), complejo de proteína de membrana (MCP), factor I (CFI), factor B (CFB), C3, entre otros. La presencia de anticuerpos que inhiben la acción de los reguladores de la vía inhibitoria, también son una causa de desregulación. (2) Adicionalmente puede existir activación de promotores positivos del complemento con la formación de MAC en las células endoteliales que dañan y lisan las mismas. (3) Estas alteraciones llevan al daño endotelial y formación de trombos de fibrina que forman agregados plaquetarios y crea daño isquémico en los órganos diana como riñones y cerebro.
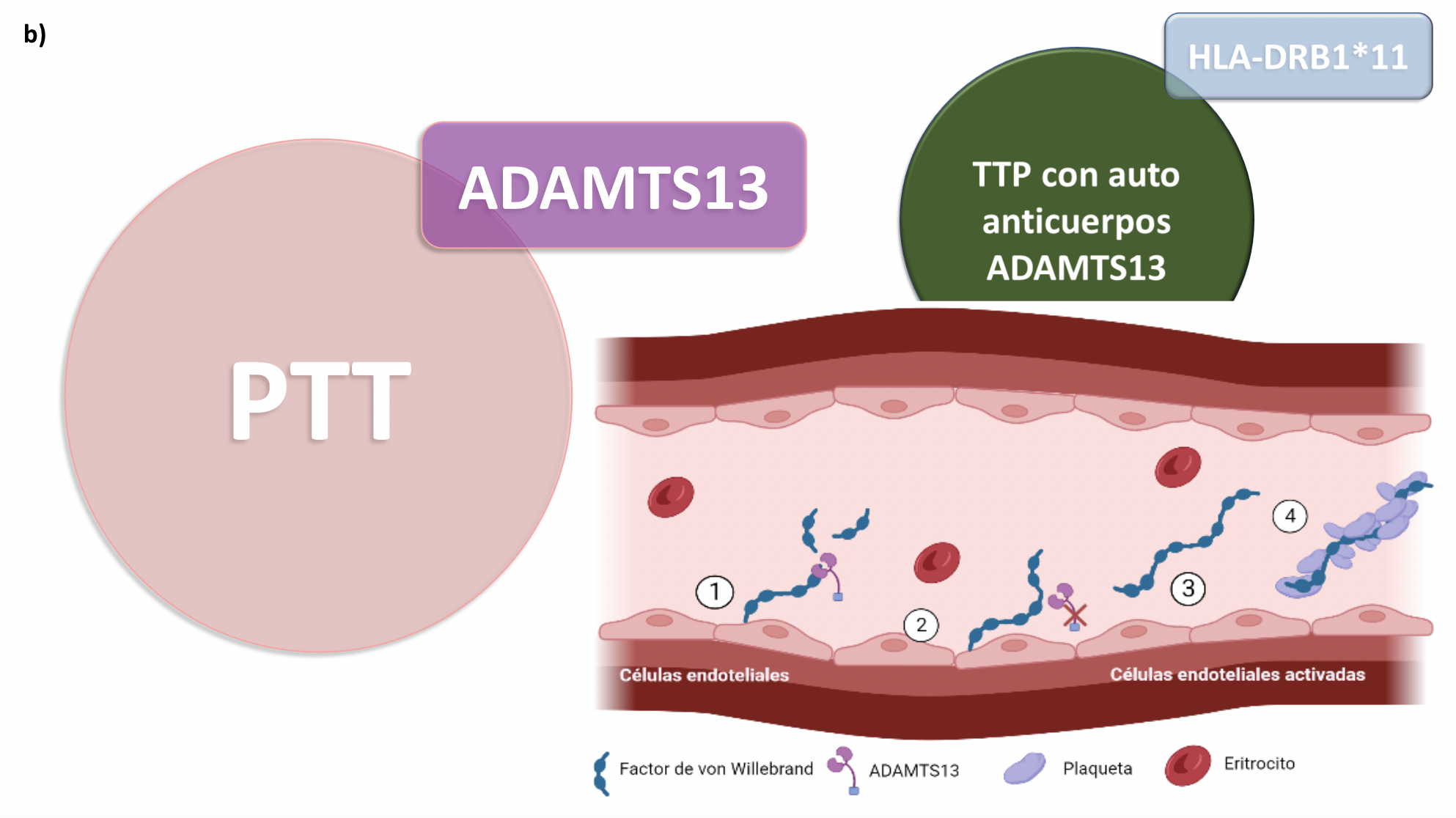
Figura 2b. La púrpura trombocitopénica trombótica (PTT) se asocia principalmente a una deficiencia de ADAMTS13. (1) su principal función es la de cortar el factor de von Willebrand (vWF); (2) su deficiencia, sea por mutaciones genéticas o auto-anticuerpos para ADAMTS13 resulta en (3) multímeros de vWF inusualmente largos que producen (4) agregación plaquetaria microvascular oclusiva en los órganos diana.
¿Cuándo es apropiado realizar un estudio genético en la MAT?
Las guías de práctica clínica recomiendan el estudio genético en todos los pacientes con síndrome hemolítico urémico atípico [8–10], sin embargo, cada vez existe más evidencia de las implicaciones diagnósticas, terapéuticas y pronósticas de la identificación de variantes genéticas relacionadas con la MAT [11–14].
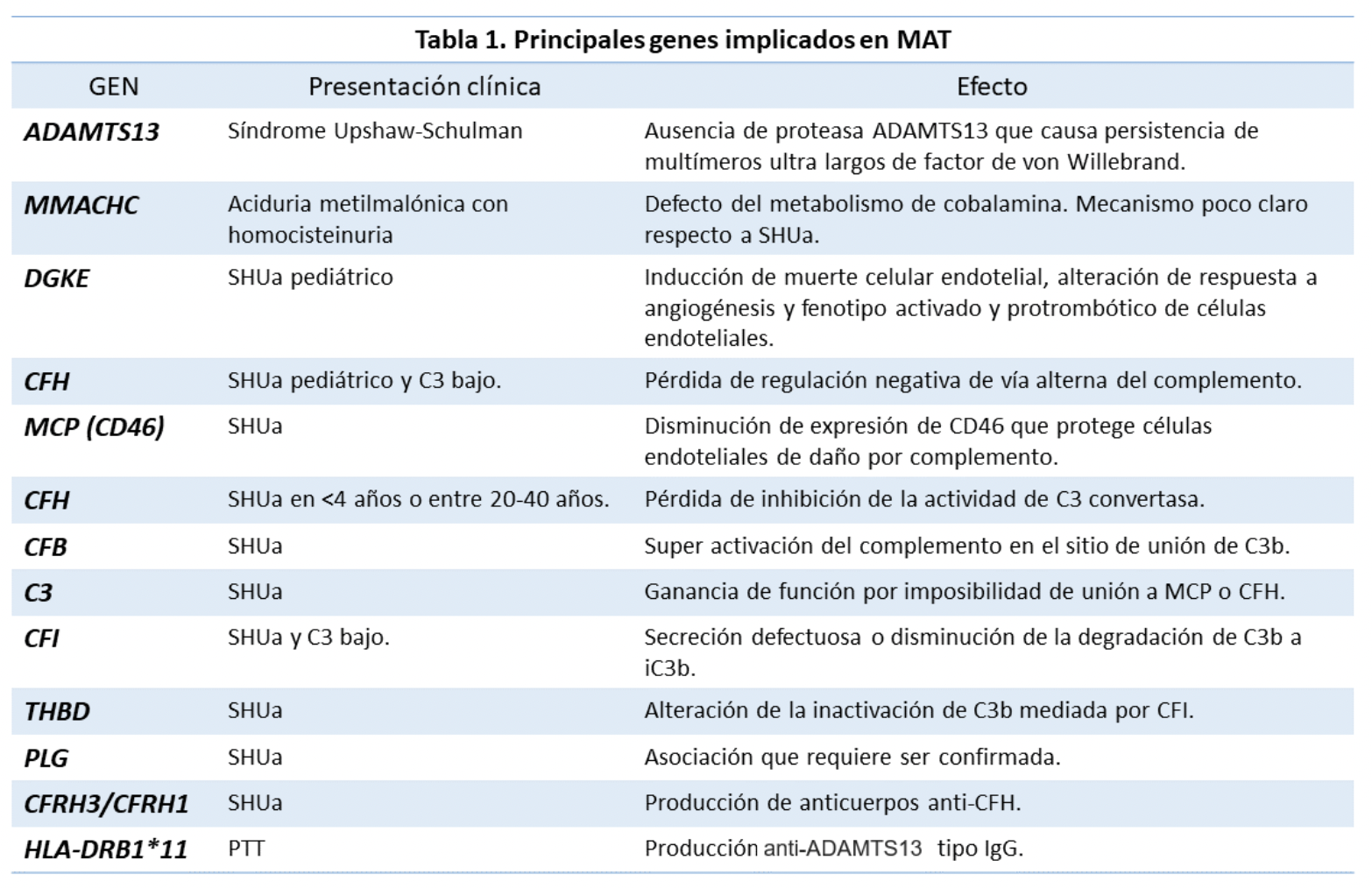
Tabla 1. Lrincipales genes implicados en la microangiopatía trombótica (MAT)
¿Cuáles son las implicaciones en el tratamiento y pronóstico?
Debido al aumento en la identificación de variables genéticas, se requiere un análisis de su impacto en la función molecular para discernir entre su relación con la manifestación de la enfermedad o una presencia fortuita sin impacto funcional [7]. Sin embargo, la presencia o ausencia de las variantes más comunes pueden ayudar a decidir el manejo terapéutico de primera línea y orientar a médicos y pacientes respecto al pronóstico y respuesta al tratamiento. Por ejemplo, los pacientes con SHUa por mutaciones de CFH tienen una alta probabilidad de desarrollar ERC terminal y una alta recurrencia posterior al trasplante [15].
Referencias
| 1. George JN, Nester CM. Syndromes of Thrombotic Microangiopathy. New England Journal of Medicine. 2014 Aug 14;371(7):654–66. |
|---|
| 2. Moake JL. Thrombotic microangiopathies. N Engl J Med. 2002 Aug 22;347(8):589–600. |
| 3. Brocklebank V, Wood KM, Kavanagh D. Thrombotic Microangiopathy and the Kidney. Clinical Journal of the American Society of Nephrology. 2018 Feb 7;13(2):300–17. |
| 4. Greenbaum LA. Atypical hemolytic uremic syndrome. Adv Pediatr [Internet]. 2014 [cited 2022 Nov 16];61(1):335–56. |
| 5. Noris M, Remuzzi G. Atypical hemolytic-uremic syndrome. N Engl J Med [Internet]. 2009 Oct 22 [cited 2022 Nov 16];361(17):1676–87. |
| 6. Noris M, Caprioli J, Bresin E, Mossali C, Pianetti G, Gamba S, et al. Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype. Clin J Am Soc Nephrol [Internet]. 2010 Oct 1 [cited 2022 Nov 16];5(10):1844–59. |
| 7. Zununi Vahed S, Rahbar Saadat Y, Ardalan M. Thrombotic microangiopathy during pregnancy. Microvasc Res. 2021 Nov;138:104226. |
| 8. Vieira-Martins P, el Sissy C, Bordereau P, Gruber A, Rosain J, Fremeaux-Bacchi V. Defining the genetics of thrombotic microangiopathies. Transfusion and Apheresis Science. 2016 Apr;54(2):212–9. |
| 9. Loirat C, Fakhouri F, Ariceta G, Besbas N, Bitzan M, Bjerre A, et al. An international consensus approach to the management of atypical hemolytic uremic syndrome in children. Pediatr Nephrol [Internet]. 2016 Jan 1 [cited 2022 Nov 16];31(1):15–39. |
| 10. Campistol JM, Arias M, Ariceta G, Blasco M, Espinosa L, Espinosa M, et al. An update for atypical haemolytic uraemic syndrome: diagnosis and treatment. A consensus document. Nefrología [Internet]. 2015 Sep [cited 2022 Nov 16];35(5):421–47. |
| 11. Taylor CM, MacHin S, Wigmore SJ, Goodship THJ. Clinical practice guidelines for the management of atypical haemolytic uraemic syndrome in the United Kingdom. Br J Haematol [Internet]. 2010 Jan [cited 2022 Nov 16];148(1):37–47. |
| 12. Bu F, Maga T, Meyer NC, Wang K, Thomas CP, Nester CM, et al. Comprehensive genetic analysis of complement and coagulation genes in atypical hemolytic uremic syndrome. Journal of the American Society of Nephrology [Internet]. 2014 Jan [cited 2022 Nov 16];25(1):55–64. |
| 13. Fakhouri F, Fila M, Provôt F, Delmas Y, Barbet C, Châtelet V, et al. Pathogenic Variants in Complement Genes and Risk of Atypical Hemolytic Uremic Syndrome Relapse after Eculizumab Discontinuation. Clin J Am Soc Nephrol [Internet]. 2017 [cited 2022 Nov 16];12(1):50–9. |
| 14. Prakash S, Gharavi AG. Diagnosing kidney disease in the genetic era. Curr Opin Nephrol Hypertens [Internet]. 2015 Jul 1 [cited 2022 Nov 16];24(4):380–7. |
| 15. Vivante A, Hildebrandt F. Exploring the genetic basis of early-onset chronic kidney disease. Nat Rev Nephrol [Internet]. 2016 Mar 1 [cited 2022 Nov 16];12(3):133–46. |
| 16. Fremeaux-Bacchi V, Fakhouri F, Garnier A, Bienaimé F, Dragon-Durey MA, Ngo S, et al. Genetics and Outcome of Atypical Hemolytic Uremic Syndrome: A Nationwide French Series Comparing Children and Adults. Clinical Journal of the American Society of Nephrology. 2013 Apr 5;8(4):554–62. |
