Enfermedad por anti-MBG e infección por COVID-19: un caso atípico de disociación clínica-histológica

Por: Dra. Cindy MonteroGranados
Patóloga, Fellow de Patología Renal
Toronto General Hospital
Toronto, Canadá

Por: Dra. Carmen Ávila-Casado
Nefropatóloga, Directora del Programa de Patología Renal
Toronto General Hospital
Toronto, Canadá
Caso Clínico
Hombre de 65 años, con antecedente de hipertensión, obesidad, diabetes tipo 2 y asma bronquial, que cursa con cuadro clínico de tos persistente y malestar general de varias semanas de evolución. Consultó al servicio de Emergencias por hemoptisis y dificultad respiratoria. Se detectó PCR para Covid-19 positiva. Al ingreso, sus análisis mostraron: creatinina sérica 1.68 mg/dL, filtración glomerular estimada (eGFR) 43 mL/min/1.73m2, hematuria microscópica, sin proteinuria y anticuerpos anti-membrana basal glomerular (anti-MBG) positivo (4.8 AI Unidades).
El paciente cursó con lesión renal aguda con empeoramiento progresivo de la función renal y síndrome de dificultad respiratoria, por lo que fue internado en la unidad de cuidados intensivos. Los anticuerpos anti-DNA, C-ANCA y P-ANCA fueron negativos y los niveles de C3/C4 eran normales. Los estudios radiológicos fueron compatibles con hemorragia alveolar. Se catalogó como síndrome pulmón-riñón y se realizó biopsia renal para descartar una posible Enfermedad por anticuerpos anti-membrana basal (anteriormente llamado Goodpasture).
Biopsia Renal
Se analizó un cilindro de tejido renal, con 11 glomérulos en total, de los cuales uno estaba globalmente esclerosado. El resto mostró leve incremento de la matriz y celularidad mesangial.
Focalmente y de manera segmentaria se identificó necrosis con ruptura de la membrana basal y fibrina (Figura 1) en un solo glomérulo y otro mostró una estructura sugerente de semiluna de tipo celular (Figura 2). No había hipercelularidad endocapilar ni alteración de las paredes de los capilares glomerulares. A nivel tubulointersticial se observó daño tubular agudo con cilindros eritrocitarios, así como cambios crónicos: inflamación intersticial crónica, tiroidización tubular, arterioesclerosis hialina y esclerosis arterial.
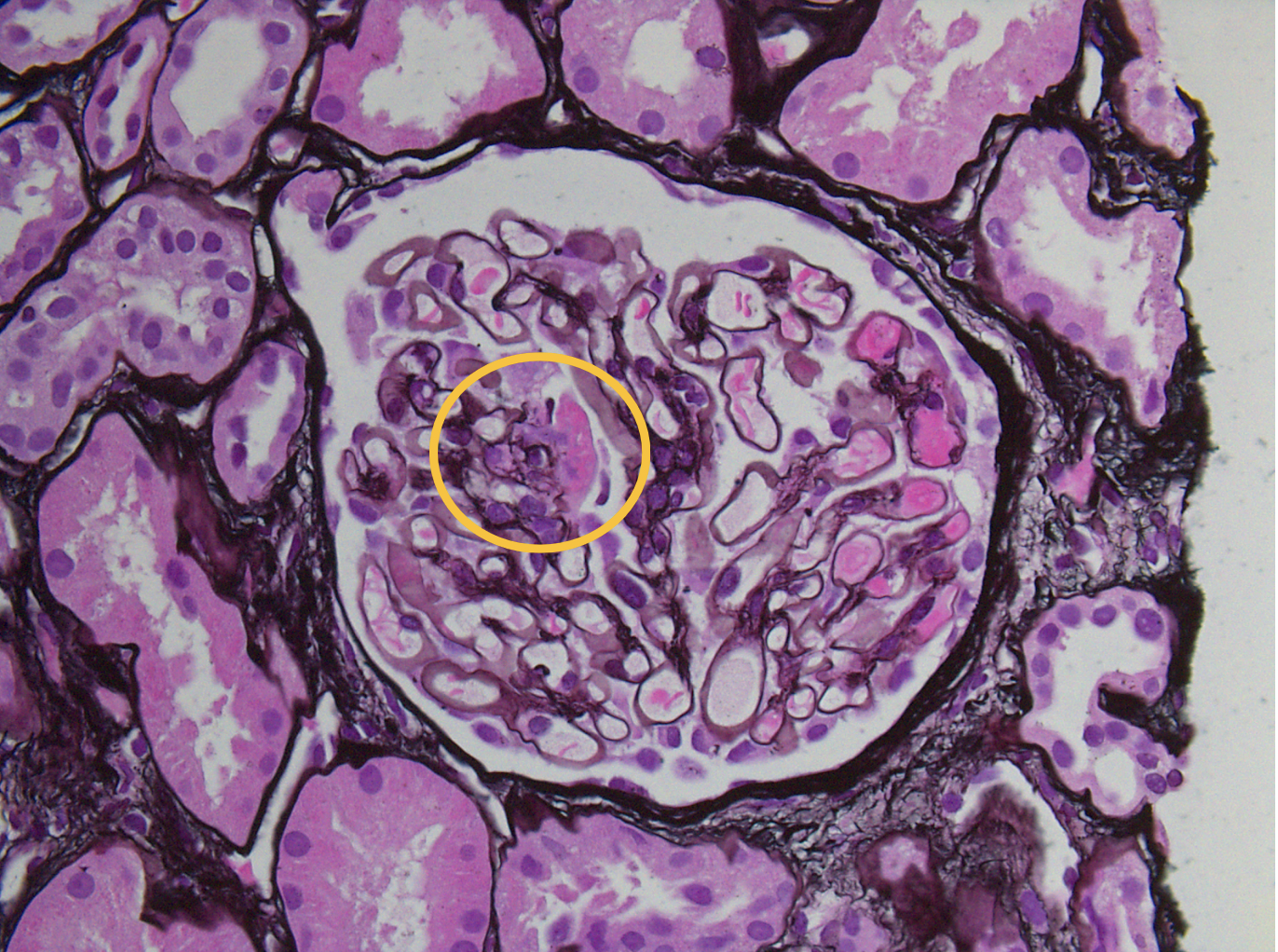
Figura 1. Microscopía óptica Glomérulo con necrosis segmentaria y ruptura de la membrana basal y presencia de fibrina (circulo amarillo). (Jones PASM 40x)
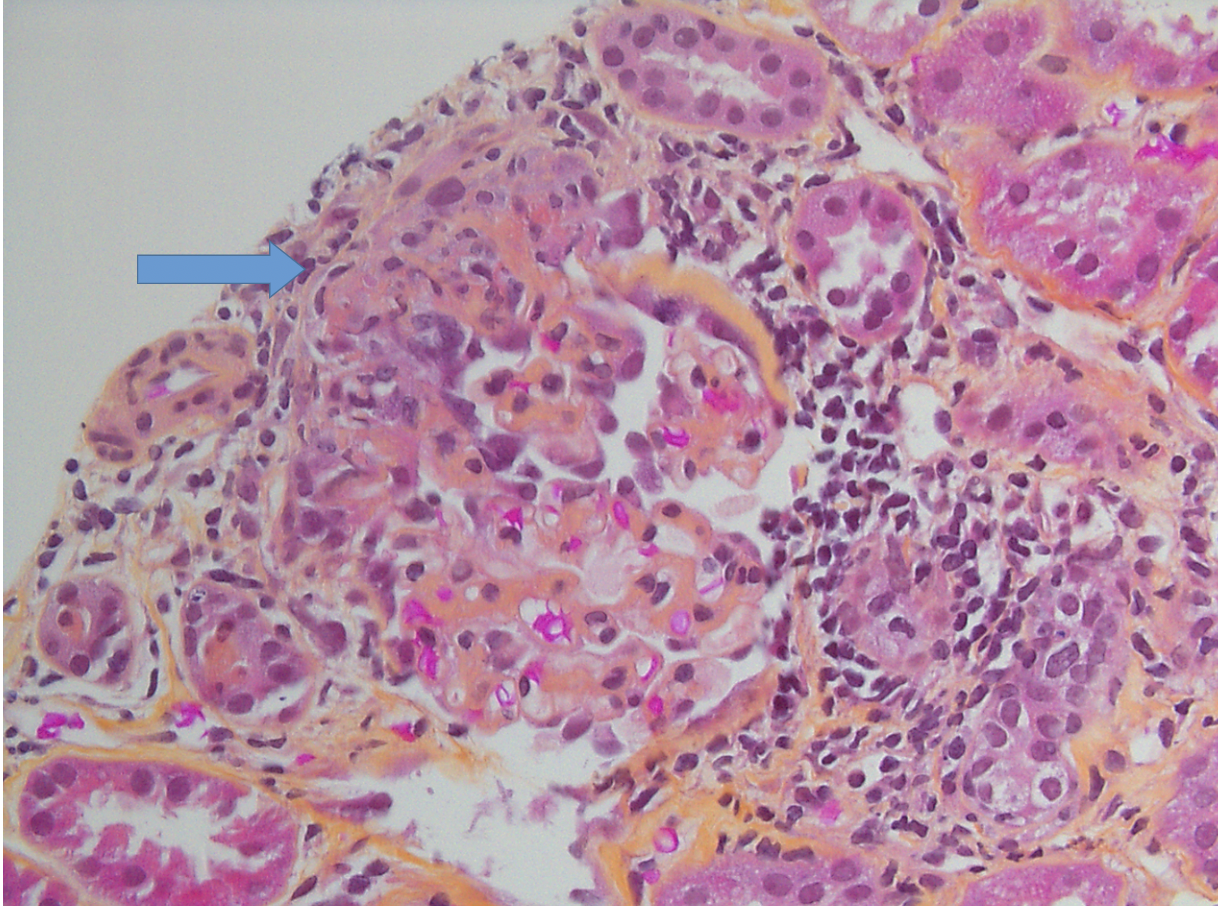
Figura 2. Microscopía óptica Semiluna celular con disrupción de la capsula de Bowman (flecha azul) subyacente al glomérulo se observa inflamación mononuclear a nivel tubulointersticial. (tinción de Hematoxilina floxina azafrán (HPS 40X)
La inmunofluorescencia reveló positividad fuerte y lineal en las membranas basales glomerulares para IgG, IgG1, IgG3, kappa y lamba (Figura 3). Positividad lineal escasa para C3. La inmunofluorescencia fue negativa para IgM, IgA y C1q.
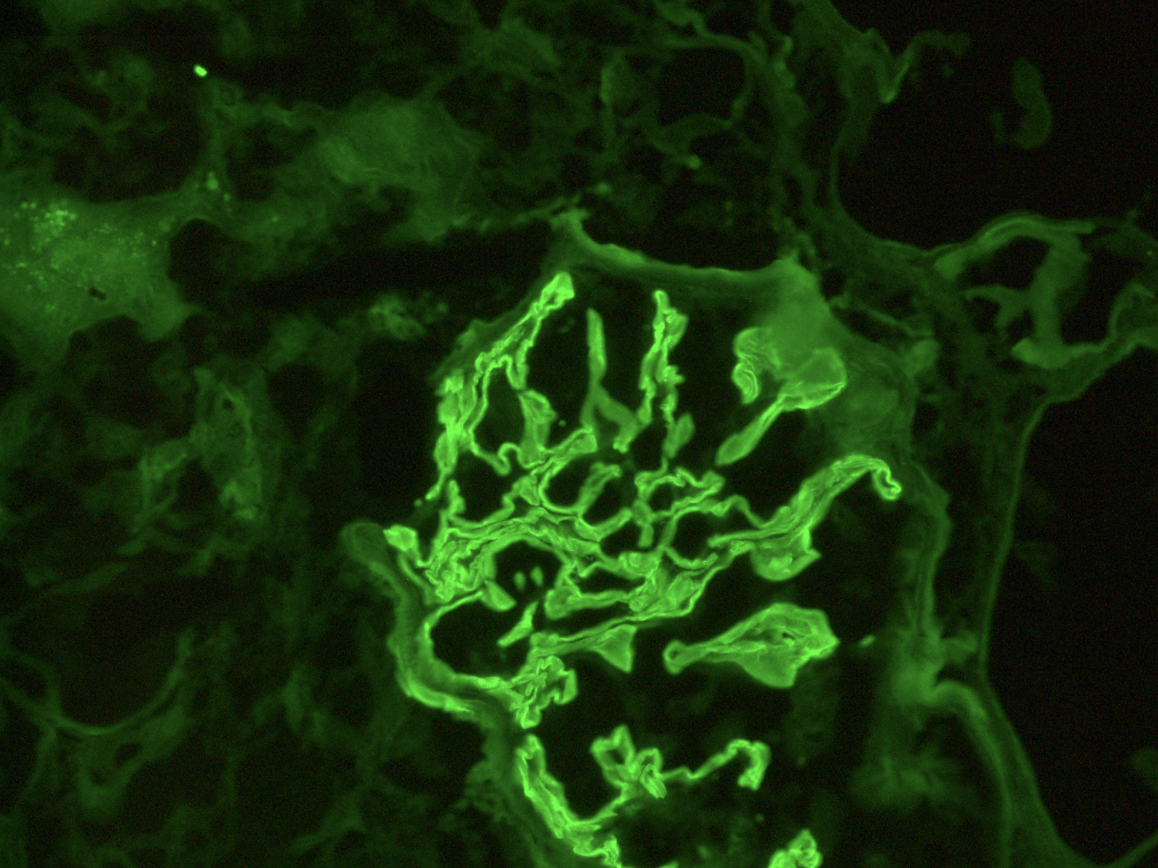
Figura 3. Inmunofluorescencia directa Fuerte positividad lineal en la membrana basal glomerular para IgG. (IgG-FITC 40X)
La microscopía electrónica descartó la presencia de depósitos inmunes electro-densos. Se evidenció la presencia de daño endotelial crónico con la formación de bandas claras subendoteliales e hipertrofia endotelial (Figura 4).
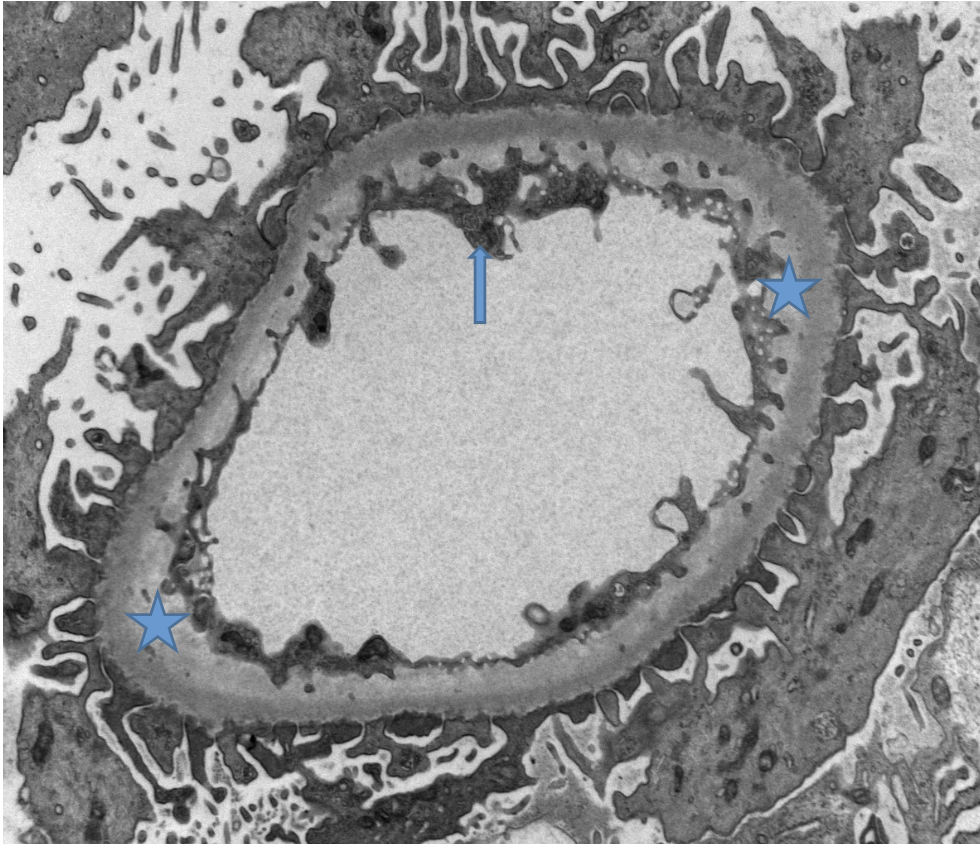
Figura 4. Microscopia electrónica de transmisión: Asa capilar que muestra expansión subendotelial formando una banda de color claro (estrellas) debida a daño endotelial crónico. Hay además hipertrofia endotelial (Flecha) (MET 10,000X).
El diagnóstico de la biopsia renal fue el siguiente:
-Enfermedad anti-membrana basal glomerular atípica posterior a infección por Covid-19 con necrosis glomerular focal asociada a cambios de microangiopatía.
-Lesión tubular aguda.
-Moderada fibrosis intersticial y atrofia tubular.
-Hialinosis arteriolar y esclerosis arterial.
Discusión
La enfermedad anti-MBG se debe a la presencia de autoanticuerpos circulantes dirigidos contra epítopos crípticos en el dominio NC1 de la cadena alfa-3 del colágeno tipo IV (α3NC1), también conocido como antígeno de Goodpasture (1). Se puede presentar como una glomerulonefritis rápidamente progresiva con o sin hemorragia pulmonar. Lo más relevante y frecuente en la biopsia renal es la positividad lineal intensa para IgG en la MBG y la presencia difusa de semilunas con necrosis fibrinoide (1,2).La presencia de depósitos policlonales de inmunoglobulinas a lo largo de la MBG constituye el gold standard para el diagnóstico (3).
La nefritis por anticuerpos anti-MBG tiene dos presentaciones: típica y atípica (1). El 10% de los casos corresponde a presentaciones atípicas (3). Esto debe tenerse muy presente durante la valoración clínica del paciente y también durante el estudio de la biopsia renal.
En el caso descrito, el paciente mostró hallazgos clínico-patológicos típicos y atípicos (Tabla 1). Debutó con compromiso renal y pulmonar, pero con elevación discreta en los niveles séricos de anti-MBG. En la valoración de la biopsia llamó la atención que, de 11 glomérulos en total, solo en un glomérulo se evidenció una semiluna celular y otro glomérulo de forma segmentaria mostró escasa necrosis con ruptura de la membrana basal y fibrina. Los estudios de inmunofluorescencia y microscopía electrónica, fueron fundamentales para confirmar que se trataba de una enfermedad anti-MBG.
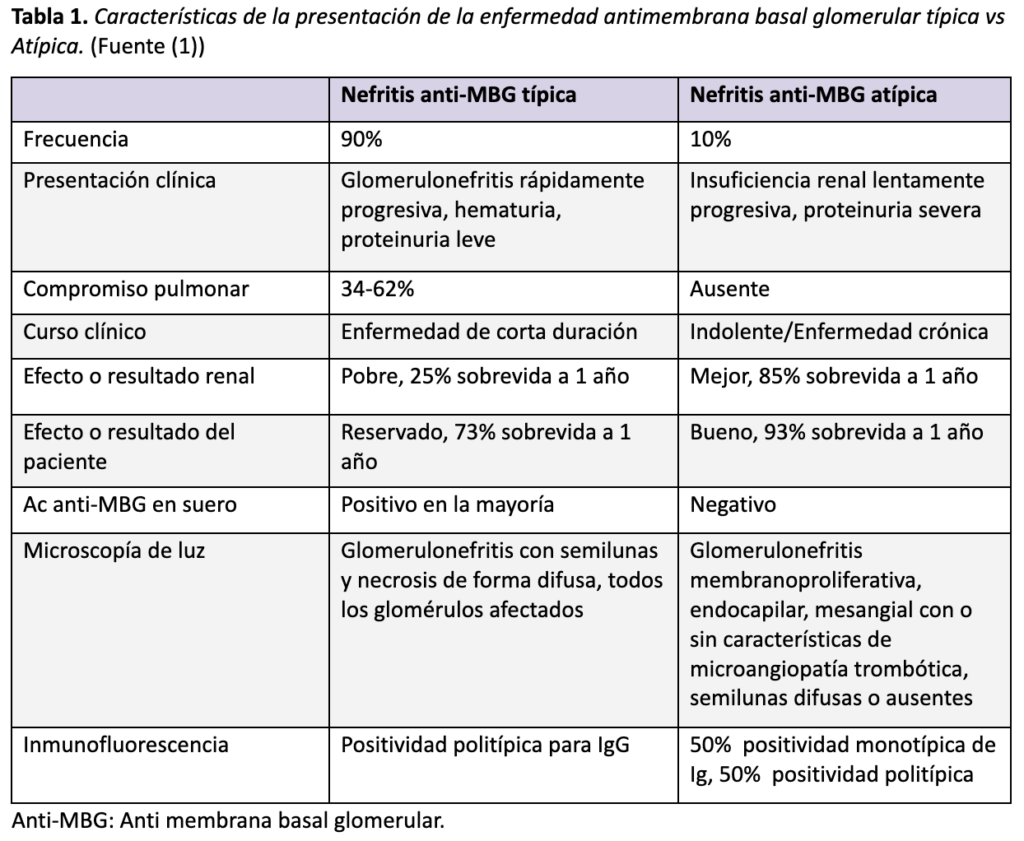
Tabla 1. Características de la presentación de la enfermedad antimembrana basal glomerular típica vs atípica. (Fuente (1))
Desde el inicio de la pandemia por SARS-CoV-2, se han publicado reportes de casos de aparición y recurrencia de enfermedad anti-MBG en pacientes con COVID-19. No queda claro el mecanismo preciso mediante el cual el virus desencadena la enfermedad; sin embargo, se conoce que el virus infecta a las células endoteliales, generando inflamación y activación del complemento, que, finalmente, conlleva a daño endotelial. Ello podría desenmascarar a los epítopos presentes en la MBG, y, los autoantígenos expuestos podrían estimular a las células B y plasmáticas a secretar autoanticuerpos responsables del desarrollo de la enfermedad, lo que puede ocurrir días o semanas después de la infección viral. También se han reportado casos de enfermedad anti-MBG en relación con la vacunación anti SARS-CoV-2. (4). En este paciente no se pudo estudiar la expresión de mRNA para SARS-CoV-2 en el tejido renal, por lo que el daño endotelial podría estar en relación con una respuesta autoinmune a la infección viral, y no tanto un daño renal directo por el tropismo del virus hacia el riñón. (4) (5)
Durante la evolución, el paciente presentó hemorragia pulmonar anemizante y fracaso renal agudo, por lo que requirió plasmaféresis y hemodiálisis temporal, además de tratamiento con glucocorticoides a dosis altas y ciclofosfamida intravenosa. Luego de ello, se observó mejoría sostenida de los anticuerpos anti-MBG (cayeron de 4.8 a 0.5 UAI, negativo<0.9 UAI), del cuadro pulmonar (desaparición de la hemoptisis y mejoría radiológica) y renal (retiro de diálisis). A pesar de los niveles séricos de anti-MBG discretamente elevados, el paciente presentó un cuadro grave, con compromiso de vida, pero con poca expresión histológica a través de la microscopía óptica, respecto a lo publicado en la literatura para casos de similar gravedad. Esta disociación clínica-histológica nos recuerda la necesidad de realizar siempre todas las técnicas disponibles en la biopsia renal, más allá de la microscopía óptica, para llegar a un diagnóstico adecuado y brindar un tratamiento oportuno.
| Referencias |
|---|
| Nasr SH, A. Collins B, Alexander MP et al. (2016). The clinicopathologic characteristics and outcome of atypical anti-glomerular basement membrane nephritis. Kidney International. Volume 89, Issue 4, April 2016, 897-908. https://doi.org/10.1016/j.kint.2016.02.001 |
| Singhal P, Ren K Y M, Curtis BM, Mc Pherson I, Avila-Casado C . (2018). Atypical Noncrescentic Antiglomerular Basement Membrane Disease With Concurrent Thin Basement Membrane Nephropathy. Kidney International Reports. Volume 3, Issue 4, July 2018, Pages 991-996. https://doi.org/10.1016/j.ekir.2018.03.012 |
| Teixeira AC, Pinto H, Oliveira N, et al. (2018). Proliferative glomerulonephritis with linear immunoglobulin deposition: is this atypical antiglomerular basement membrane disease? BMJ Case Reports. https://dx.doi.org/10.1136/bcr-2017-223198 |
| Prema KSJ, Kurien A. Incidence of anti-glomerular basement membrane disease during the COVID-19 pandemic. Clin Kidney J. 2021 Oct 20;15(1):180-181. doi: 10.1093/ckj/sfab204. PMID: 35028133; PMCID: PMC8574335. |
| Meijers B, Hilbrands LB. The clinical characteristics of coronavirus-associated nephropathy. Nephrol Dial Transplant. 2020 Aug 1;35(8):1279-1281. https://10.1093/ndt/gfaa197 |

Muy interesante caso y con actualización del tema