Enfermedad renal mediada por APOL1: una historia en constante evolución

Por: Sol Carriazo, MD
Nefróloga
Hereditary Kidney Disease Fellowship en Toronto General Hospital
Toronto, Canadá
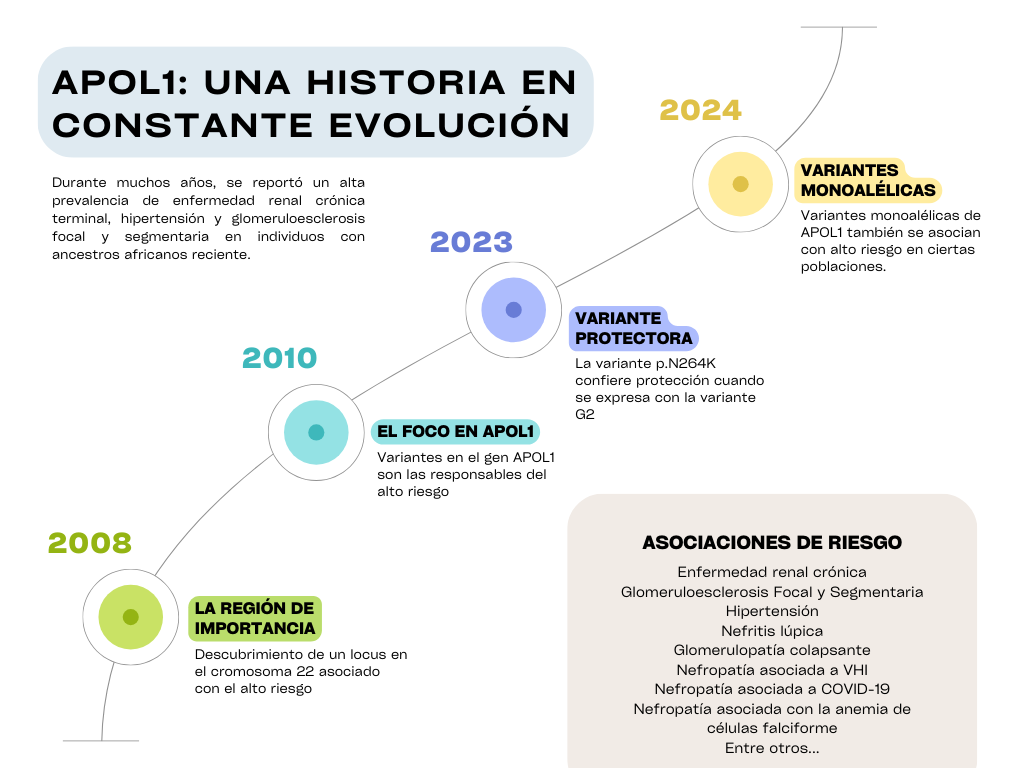
Durante muchos años, llamaba la atención la desproporcionadamente elevada incidencia de enfermedad renal crónica terminal (ERCT) en población afrodescendiente en Estados Unidos. (1) (Figura 1). Dicha enfermedad renal cumplía ciertas características: no se explicaba por la presencia de diabetes, la causa más común de ERC, y se destacaba por la elevada prevalencia de hipertensión. Debido a esto, múltiples estudios epidemiológicos apuntaban a que la hipertensión podría ser la causa de esta, acompañada de factores sociodemográficos.

Figura 1. Prevalencia ajustada de enfermedad renal crónica terminal de acuerdo a la etnia 2001-2021. (Datos de USRD)
En 2008, utilizando el método de mapeo por desequilibrio de ligamiento por mezclas, dos estudios descubrieron un locus en el cromosoma 22 como el impulsor genético de la alta prevalencia de ERCT asociada a hipertensión y de glomeruloesclerosis focal y segmentaria (GEFyS) en afroamericanos (2, 3). Inicialmente, se creía que el responsable de esta gran diferencia era el gen MYH9, el cual codifica para la cadena pesada de la miosina no muscular IIA, una proteína contráctil del citoesqueleto que se expresa de forma constitutiva en los podocitos y también se encuentra en las plaquetas. Las mutaciones en este gen se han asociado con trombocitopenia, daño renal y sordera (4).
Sin embargo, fue en el año 2010, cuando se identificó que no era el gen MYH9, el responsable, sino variantes en el gen APOL1, las que explicaban esta elevada prevalencia (5, 6).
El gen APOL1, descubierto en 1997, se encuentra situado en el cromosoma 22, y codifica para la apolipoproteína 1, involucrada en la inmunidad innata (7). La variante wild type (G0), fue identificada en el 2003 como un componente en el suero que confería resistencia al Tripanosoma Brucei (T. Brucei), el agente causante de la tripanosomiasis africana (enfermedad del sueño). Y la historia se remonta a hace aproximadamente 10 000 años, cuando 2 nuevas sepas de T. Brucei emergieron en África, y eran resistentes a la respuesta inmune humana; por lo tanto, las variantes G1 y G2 surgieron mediante selección positiva, para restaurar la protección contra el T. Brucei (8).
Sin embargo, pese a que las variantes G1 (p.S342G y p.I384M) y G2 (una deleción de dos aminoácidos, p.N388/Y389) del gen APOL1, confieren resistencia contra el tripanosoma mediante la formación de poros en su membrana lisosomal, induciendo estrés osmótico y lisis, esta misma función, se traduce en su citotoxicidad en células humanas específicas, como los podocitos. (8)
Modelos experimentales muestran que la expresión de la proteína en el podocito, es suficiente para causar daño. Pese a que los mecanismos moleculares no están completamente dilucidados, se ha demostrado que G1 y G2 incrementan el eflujo de potasio y el influjo de sodio en el podocito, desencadenando una cascada de señales citotóxicas que causan daño podocitario, glomeruloesclerosis y fallo renal (9).
Posteriormente, múltiples estudios epidemiológicos permitieron concluir que el riesgo de ERC asociado con APOL1 G1 y G2 es elevado cuando dichas variantes se heredan en homocigosis o heterocigosis compuesta, lo que significa que individuos que son heterocigóticos simples para la variante G1 o G2 (G1/G0, G2/G0), son resistentes a la enfermedad del sueño africana, pero no tienen riesgo de enfermedad renal. Contrario a aquellos con 2 alelos G1 o G2 de APOL1 en cualquier combinación (G1/G1, G1/G2 o G2/G2), quienes sí tienen un alto riesgo de enfermedad renal (10).
La frecuencia poblacional de los alelos varía alrededor del mundo. La prevalencia es muy alta en poblaciones del oeste africano. Por ejemplo, en Nigeria, la frecuencia del G1 puede ir de 37 a 45%, y G2 hasta de 7.5 a 17%. En Estados Unidos, con una población con ancestros africanos recientes de 13-14%, la frecuencia de G1 y G2 es 22% y 13%, respectivamente. Se reporta que más de 5 millones de personas (13% de la población ancestros africanos recientes) tiene un genotipo de alto riesgo. Por su parte, también se encuentran elevadas en África sub-Sahariana, otros países de África Occidental, el Caribe, Centro América, y Sudamérica (11) En América Latina, pese a que existen más de 130 millones de individuos con ancestros africanos recientes, la prevalencia de variantes de alto riesgo de APOL1 ha sido menos explorada. Estudios publicados en Brasil y Colombia, indican que podría haber mayor prevalencia de individuos con genotipos de alto riesgo, haciendo un llamado a la realización de más estudios que permitan evaluar esta asociación con la prevalencia de ERC (12, 13).
La asociación entre genotipos de alto riesgo, y el riesgo a lo largo de la vida de diferentes enfermedades renales ha sido explorada por diversos estudios. La GEFyS (OR=15 – 20), nefropatía asociada a VIH (OR = 29 en Estados Unidos, y 89 en Sudáfrica), nefropatía asociada a la anemia de células falciformes, nefropatía lúpica, entre otros. (10) Más recientemente, se asoció con la presencia de fracaso renal agudo en pacientes con COVID-19 (14). En una cohorte descrita por May y colaboradores, se reportó una elevada incidencia de glomerulopatía colapsaste en riñones nativos, en la que cerca del 92% tenían un genotipo de alto riesgo (15).
En cuanto al trasplante renal, una serie de estudios han reportado que el fallo del injerto renal en contexto de donante cadáver es casi dos veces mayor en aquellos portadores de genotipo de alto riesgo, comparados con genotipo de bajo riesgo (16). Otros estudios han descrito un aumento de riesgo de ERCT en los donantes portadores de genotipo de alto riesgo (17), reportando, además, que dichos donantes tenían una TFGe más baja antes del trasplante, y mayor deterioro de la función renal tras el trasplante, comparado con donantes de genotipo de bajo riesgo. Aún queda mucho por entender sobre las implicaciones de las variantes de APOL1 en el trasplante renal. El estudio APOLLO (APOL1 Long-term Kidney Transplantation Outcomes), que se encuentra en marcha, busca evaluar la asociación con los resultados tras el trasplante renal y se espera obtener más datos que permitan tomar mejores decisiones (18, 19).
No obstante, pese al riesgo reportado de enfermedad renal mediada por APOL1, el riesgo a lo largo de la vida de GEFS y otras formas de enfermedad renal es menor del 20%, sugiriendo la existencia de un segundo hit para iniciar el daño, dentro de los cuales podemos encontrar modificadores genéticos, infecciosos y ambientales, como por ejemplo las infecciones virales (VHI y SARS-CoV-2), y otros factores sistémicos asociados con una elevación en los niveles de interferón. Lo anterior resalta la importancia de estudios que permitan comprender y determinar los factores que podrían modificar esta condición (10).
Un avance significativo en la comprensión de los factores modificadores es la identificación de la variante p.N264K (chr22:36265628C > A; rs73885316) como un alelo protector dentro del haplotipo G2. Esta variante, modifica la citotoxicidad inherente a G2, equiparándola a la del haplotipo G0. Gupta y colaboradores demostraron que la presencia de p.N264K reduce la incidencia de GEFS, y ERC asociada a G2. Este hallazgo redefine los criterios de clasificación de riesgo y abre la puerta a estrategias de manejo más personalizadas. La historia de la variante p.N264K es muy interesante, regresándonos al año 2013, en Ghana, donde un paciente que presentó una infección atípica por T. brucei gambiense y carecía de la glicoproteína T.b gambiense, sorprendentemente era portador del genotipo de alto riesgo G2/G2, que en teoría, tuvo que haberlo protegido de la infección (20). En un esfuerzo por caracterizar cómo la sangre de este paciente perdió el efecto tripanolítico, los autores secuenciaron y caracterizaron variantes adicionales de APOL1, mostrando que la variante p.N264K, una variante de pérdida de función, resultaba protectora en presencia del genotipo de alto riesgo, afectando la interacción de la proteína con la membrana endolisosomal del tripanosoma. Estudios subsecuentes demostraron que la citotoxicidad G2 se encontraba reducida en presencia de p.N264K, y fue posteriormente reportado en múltiples cohortes (21). Dichos estudios demuestran, que la evaluación de APOL1 sin la evaluación de la variante p.N264K se consideraría incompleta.
Y cuando creímos que el panorama estaba más claro, en octubre de 2024, Gbadegesin, y colaboradores, (22) publican los resultados de un estudio de casos y controles incluyendo pacientes de Ghana y Nigeria, con ERC G 2-5, enfermedad glomerular comprobada por biopsia y pacientes sin enfermedad renal. Interesantemente, los autores reportaron que los participantes con un sólo alelo de riesgo tenían mayor riesgo de tener ERC (OR ajustado = 1.18; IC 95%: 1.04 – 1.33) y GEFS (OR ajustado= 1.61; IC 95%: 1.04 – 2.48) que aquellos con 0 alelos de riesgo (22). Desafortunadamente no fue posible genotipificar la variante M1, lo cual tendría implicaciones a la hora de reclasificar a los pacientes. Sin embargo, esta publicación abre la puerta para la realización de más estudios que permitan determinar si presentar los haplotipos G0/G1, G0/G2, en presencia o ausencia de M1, estaría asociado con una mayor incidencia de daño renal, que aquellos sin alelos de riesgo en poblaciones específicas. La figura 2 muestra la distribución de genotipos de riesgo según el conocimiento actual.

Figura 2. Riesgo de enfermedad renal mediada por APOL1 según la combinación de haplotipos. El riesgo de las variantes monoalélicas (G1/G0, G2/G0) deben ser confirmado por más estudios.
El desarrollo de terapias dirigidas contra APOL1 ha avanzado significativamente en la última década. Dentro de las más prometedoras se encuentran Inaxaplina (VX-147), un inhibidor de la función poro-formadora de APOL1 que ha demostrado reducir la proteinuria en pacientes con variantes de riesgo en ensayos clínicos de fase 2 (23, 24) y Baricitinib, un inhibidor de JAK-STAT, que bloquea la expresión inducida por interferones de APOL1, también en estudio (estudio JUSTICE) (25). Por otra parte, recientemente, Karreci y colaboradores, reportaron que lisinopril reducía la proteinuria y glomeruloesclerosis en un modelo murino de GEFS inducida por APOL1, no siendo así para hidralazina y dapagliflozina (26). La tabla 1 muestra un resumen de los principales ensayos clínicos registrados en clinicaltrials.gov.
| Número | Medicamento | Mecanismo de Acción | Población | Fase | Estado |
|---|---|---|---|---|---|
| NCT05324410 | VX-840 | Bloqueante del canal APOL1 | Participantes sanos | 1 | Completado |
| NCT05237388 | Barticinib | Inhibición de Janus Kinase-STAT | Participantes con ancestros africanos recientes con GEFS asociada a APOL1 y ERC no diabética asociada a APOL1, en relación con hipertensión | 2 | Reclutando |
| NCT04340362 | VX-147 | Bloqueante del canal APOL1 | Adultos con GEFS mediada por APOL1 | 2a | Completado |
| NCT05312879 | VX-147 | Bloqueante del canal APOL1 | Adultos y niños con ERC proteinúrica mediada por APOL1 | 2/3 | Reclutando |
Tabla 1. Ensayos clínicos activos en clinicaltrials.gov. Adaptado de (27). GEFS: Glomeruloesclerosis focal y segmentaria; ERC: enfermedad renal crónica.
Finalmente, al gran avance del conocimiento con respecto a la enfermedad renal mediada por APOL1 se le suman retos y desafíos éticos. Por ejemplo, la decisión de qué pacientes tienen indicación de estudios genético. La asignación de etnia o de ancestro africano reciente en muchos registros tiende a ser autorreportada, y ¿qué sucede con los individuos de poblaciones mestizas en los que también pueden existir variantes de alto riesgo? Tampoco parece conveniente realizar estudios genéticos a todos los donantes renales independientemente de la etnia. Por otro lado, es importante considerar el término ancestro africano reciente, ya que no todas las regiones de África tienen una prevalencia similar, y que hay diferencias considerables según grupos étnicos, incluso dentro de un mismo país, siendo más alta en África occidental, central y sur, pero más baja en África del este. Esto también es un reto para la población con ancestros africanos recientes en Latinoamérica, en la que es posible que no se sepa el origen específico de los ancestros (19).
En resumen, el conocimiento de la enfermedad renal mediada por APOL1 ha venido aumentando significativamente con los años, y es un ejemplo palpable de la puesta en práctica del enfoque de medicina de precisión desde su diagnóstico, hasta el desarrollo de medidas terapéuticas. Pese a los avances hasta la fecha, queda mucho camino por recorrer. En América Latina, donde la diversidad genética y la carga de ERC son significativas, se necesitan más estudios para evaluar la verdadera prevalencia de los haplotipos de riesgo, y de la enfermedad renal mediada por APOL1.

| Referencias |
|---|
| 1. United States Renal Data System. 2023 USRDS Annual Data Report: Epidemiology of kidney disease in the United States. National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, 2023 |
| 2. Kopp JB, Smith MW, Nelson GW, Johnson RC, Freedman BI, Bowden DW, et al. MYH9 is a major-effect risk gene for focal segmental glomerulosclerosis. Nat Genet. 2008;40(10):1175-84 |
| 3. Kao WH, Klag MJ, Meoni LA, Reich D, Berthier-Schaad Y, Li M, et al. MYH9 is associated with nondiabetic end-stage renal disease in African Americans. Nat Genet. 2008;40(10):1185-92. |
| 4. Rao M, Balakrishnan VS. The genetic basis of kidney disease risk in African Americans: MYH9 as a new candidate gene. Am J Kidney Dis. 2009;53(4):579-83 |
| 5. Tzur S, Rosset S, Shemer R, Yudkovsky G, Selig S, Tarekegn A, et al. Missense mutations in the APOL1 gene are highly associated with end stage kidney disease risk previously attributed to the MYH9 gene. Hum Genet. 2010;128(3):345-50 |
| 6. Genovese G, Friedman DJ, Ross MD, Lecordier L, Uzureau P, Freedman BI, et al. Association of trypanolytic ApoL1 variants with kidney disease in African Americans. Science. 2010;329(5993):841-5 |
| 7. Limou S, Dummer PD, Nelson GW, Kopp JB, Winkler CA. APOL1 toxin, innate immunity, and kidney injury. Kidney Int. 2015;88(1):28-34 |
| 8. Hopper T, Olabisi OA. APOL1-Mediated Kidney Disease. JAMA. 2024;331(19):1668-9 |
| 9. Olabisi, Opeyemi A. Has APOL1 kidney disease treatment been hiding in plain sight? Kidney International, Volume 106, Issue 6, 1015-1017. |
| 10. Friedman DJ, Pollak MR. APOL1 Nephropathy: From Genetics to Clinical Applications. Clin J Am Soc Nephrol. 2021;16(2):294-303 |
| 11. Nadkarni GN, Gignoux CR, Sorokin EP, Daya M, Rahman R, Barnes KC, et al. Worldwide Frequencies of APOL1 Renal Risk Variants. N Engl J Med. 2018;379(26):2571-2 |
| 12. Riella C, Siemens TA, Wang M, Campos RP, Moraes TP, Riella LV, et al. APOL1-Associated Kidney Disease in Brazil. Kidney Int Rep. 2019;4(7):923-9 |
| 13. Duran CE, Ramírez A, Posada JG, Schweineberg J, Mesa L, Pachajoa H, et al. Prevalence of APOL1 Risk Variants in Afro-Descendant Patients with Chronic Kidney Disease in a Latin American Country. Int J Nephrol. 2019;2019:7076326. |
| 14. Larsen CP, Wickman TJ, Braga JR, Matute-Trochez LA, Hasty AE, Buckner LR, et al. Risk Variants and Acute Kidney Injury in Black Americans with COVID-19. Clin J Am Soc Nephrol. 2021;16(12):1790-6 |
| 15. May RM, Cassol C, Hannoudi A, Larsen CP, Lerma EV, Haun RS, et al. A multi-center retrospective cohort study defines the spectrum of kidney pathology in Coronavirus 2019 Disease (COVID-19). Kidney Int. 2021;100(6):1303-15 |
| 16. Freedman BI, Pastan SO, Israni AK, Schladt D, Julian BA, Gautreaux MD, et al. APOL1 Genotype and Kidney Transplantation Outcomes From Deceased African American Donors. Transplantation. 2016;100(1):194-202 |
| 17. Doshi MD, Ortigosa-Goggins M, Garg AX, Li L, Poggio ED, Winkler CA, et al. Genotype and Renal Function of Black Living Donors. J Am Soc Nephrol. 2018;29(4):1309-16. |
| 18. Freedman BI, Moxey-Mims MM, Alexander AA, Astor BC, Birdwell KA, Bowden DW, et al. Long-term Kidney Transplantation Outcomes Network (APOLLO): Design and Rationale. Kidney Int Rep. 2020;5(3):278-88 |
| 19. Parekh RS. The Road to APOL1 Genetic Testing in Transplantation. Clin J Am Soc Nephrol. 2024;19(4):415-7 |
| 20. Cuypers B, Lecordier L, Meehan CJ, Van den Broeck F, Imamura H, Büscher P, et al. Apolipoprotein L1 Variant Associated with Increased Susceptibility to Trypanosome Infection. mBio. 2016;7(2):e02198-15 |
| 21. Gupta Y, Friedman DJ, McNulty MT, Khan A, Lane B, Wang C, et al. Strong protective effect of the APOL1 p.N264K variant against G2-associated focal segmental glomerulosclerosis and kidney disease. Nat Commun. 2023;14(1):7836 |
| 22. Gbadegesin RA, Ulasi I, Ajayi S, Raji Y, Olanrewaju T, Osafo C, et al. Bi- and Monoallelic Variants and Chronic Kidney Disease in West Africans. N Engl J Med. 2024 |
| 23. Egbuna O, Zimmerman B, Manos G, Fortier A, Chirieac MC, Dakin LA, et al. Inaxaplin for Proteinuric Kidney Disease in Persons with Two. N Engl J Med. 2023;388(11):969-79 |
| 24. Egbuna O, Audard V, Manos G, Tian S, Hagos F, Chertow GM. Safety and Tolerability of the APOL1 Inhibitor, Inaxaplin, following Single- and Multiple-Ascending Doses in Healthy Adults. Glomerular Dis. 2024;4(1):64-73. |
| 25. Olabisi OA, Barrett NJ, Lucas A, Smith M, Bethea K, Soldano K, et al. Design and Rationale of the Phase 2 Baricitinib Study in Apolipoprotein L1-Mediated Kidney Disease (JUSTICE). Kidney Int Rep. 2024;9(9):2677-84 |
| 26. Sula Karreci E, Jacas S, Donovan O, Pintye D, Wiley N, Zsengeller ZK, et al. Differing sensitivities to angiotensin converting enzyme inhibition of kidney disease mediated by APOL1 high-risk variants G1 and G2. Kidney Int. 2024;106(6):1072-85 |
| 27. Vasquez-Rios G, De Cos M, Campbell KN. Novel Therapies in. Kidney Int Rep. 2023;8(11):2226-34 |
