Inmunosupresión en Nefropatía Membranosa: ¿Dónde estamos actualmente?


Por: Dr. Jorge Eduardo Gaytan Arocha
Médico Internista/Nefrólogo y Nefrología del Trasplante
Hospital Regional de Alta Especialidad ISSSTE, Torreón, Coahuila
Facultad de Medicina, Universidad Autónoma de Coahuila, Unidad Torreón
Unidad Médica de Alta Especialidad No. 71, IMSS
Torreón, México

Por: Dr. Alejandro García Rivera
Nefrólogo/ Nefrólogo Intervencionista
Hospital General Regional 46, IMSS
Guadalajara, México
El tratamiento de la nefropatía membranosa (NM) ha recorrido un largo camino desde que Coggins et al. y Ponticelli et al. lideraron los primeros ensayos en busca de la mejor estrategia de tratamiento. Estos primeros ensayos marcaron el comienzo de la búsqueda de las estrategias de tratamiento más efectivas. Estudios posteriores, tanto antes como después al descubrimiento de PLA2R, han investigado más a fondo la eficacia de varios regímenes. En este contexto, nuestro objetivo es analizar exhaustivamente el panorama actual de los tratamientos inmunosupresores en la NM.
¿Es necesario el tratamiento inmunosupresor para todos?
La remisión espontánea completa o parcial ocurre en el 5-30 % y el 25-40 % de los pacientes con NM, respectivamente.[1] Considerando el riesgo de complicaciones, el tratamiento inmunosupresor se limita a los pacientes considerados en riesgo de lesión renal progresiva. Las guías KDIGO 2021 han establecido criterios clínicos para evaluar el riesgo de pérdida progresiva de la función renal.[2]
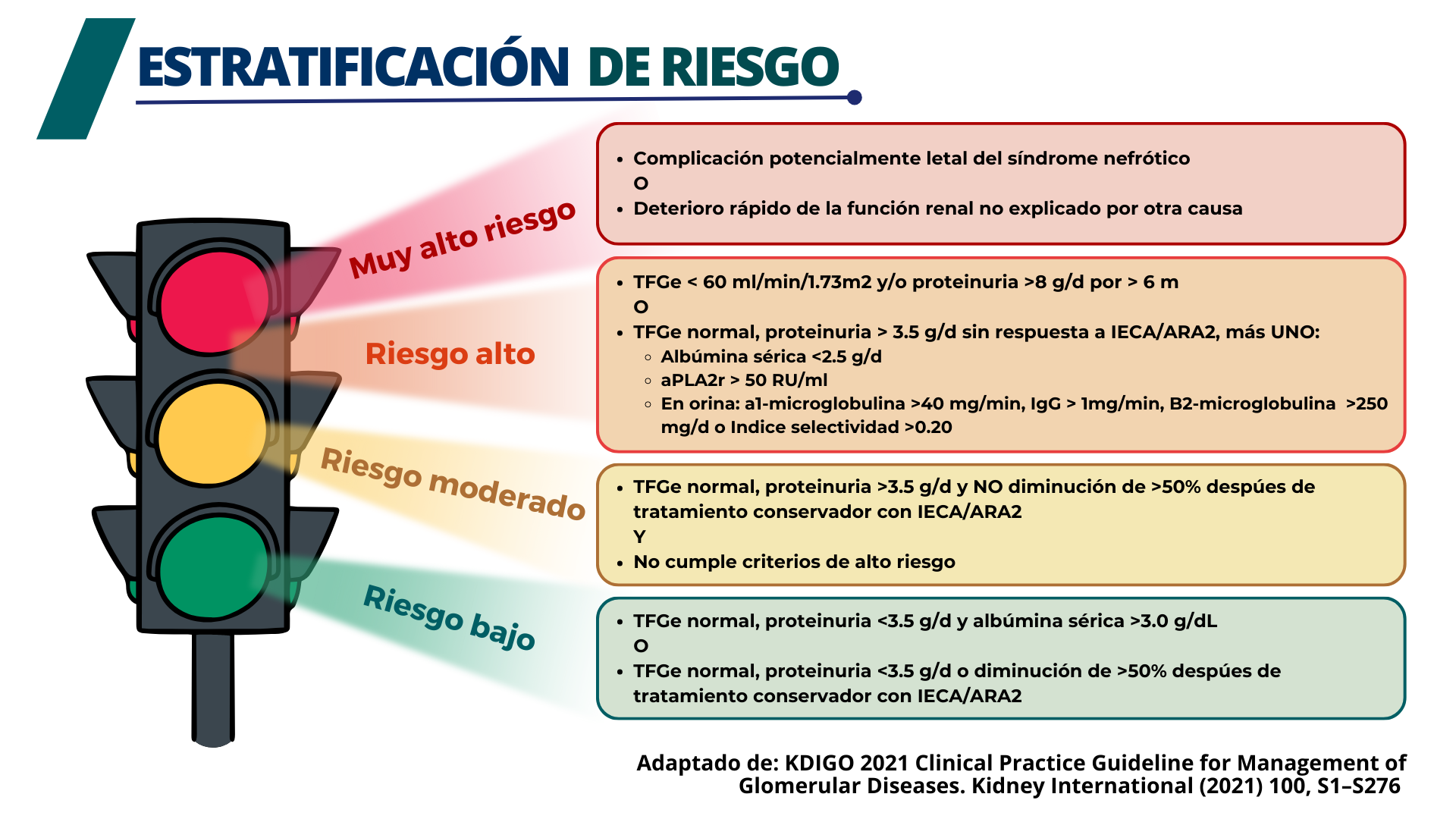
Figura 1. Estratificación de riesgo de progresión en Nefropatía Membranosa. Adaptado de: KDIGO 2021 Clinical Practice Guideline for Management of Glomerular Diseases. Kidney International (2021) 100, S1–S276
Los pacientes con riesgo bajo y algunos con riesgo moderado pueden recibir tratamiento de soporte y vigilancia durante 6 meses. El tratamiento de soporte incluye los siguiente:
- Restricción de sodio en la dieta (<2 g/día)
- Control estricto de la presión arterial (PAS < 120 mmHg)
- Terapia antiproteinúrica no inmunosupresora (TANI) con inhibición del sistema renina-angiotensina (RAS) aumentada hasta la dosis máxima tolerada. Recientemente, el uso de inhibidores SGLT2 podrían ser una terapéutica adicional para reducir la proteinuria
¿Qué regímenes inmunosupresores podemos utilizar?
La MN se caracteriza por la presencia de depósitos subepiteliales de inmunocomplejos. Se habla de MN “primaria” cuando hay una respuesta humoral a un antígeno podocitario, más comúnmente a través de autoanticuerpos anti-PLA2R, aunque sabemos que hay muchos más antígenos. Los depósitos de inmunocomplejos causan daño podocitario y de la membrana basal glomerular, con proteinuria que conduce al síndrome nefrótico y, eventualmente, a la insuficiencia renal.
El primer ensayo que intentó responder a esta pregunta fue liderado por Coggins et al., publicado en 1979, comparando esteroides vs. placebo. [3] Durante casi dos décadas, el clorambucilo, la ciclofosfamida (CYC) y los glucocorticoides (GC) fueron los pilares del tratamiento basados en los estudios de Ponticelli et al. [4] Los inhibidores de la calcineurina (ICN) y el rituximab (RTX) se introdujeron posteriormente, y los ensayos controlados aleatorizados (ECA) recientes han demostrado su utilidad. Con toda esta información, debemos tomar una decisión informada basada en un balance de beneficios, efectos adversos y, por supuesto, los recursos locales que tenemos para ofrecer a los pacientes. Las pautas KDIGO 2021 sugieren un tratamiento basado en la estratificación de riesgo para la MN:
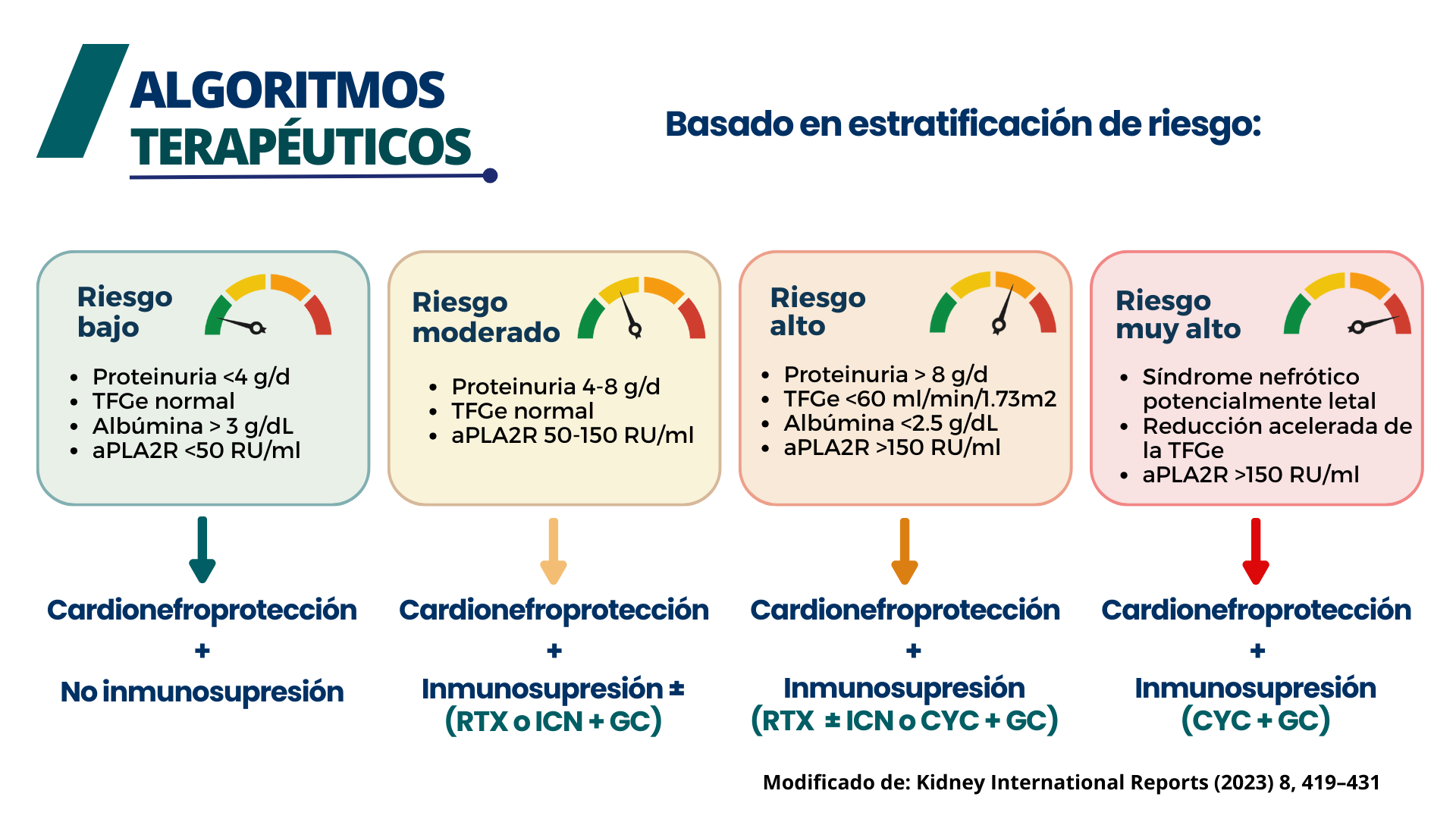
Figura 2. Algoritmo de tratamiento basado en la estratificación de riesgo de progresión en Nefropatía Membranosa. Adaptado de: Rojas-Rivera, J. E., Ortiz, A., & Fervenza, F. C.. Novel Treatments Paradigms: Membranous Nephropathy. Kidney Int Rep. 2023 Jan 2;8(3):419-431.
Rituximab: evidencia de su eficacia
RTX es un anticuerpo IgG1 quimérico monoclonal anti-CD20 que depleta las células B CD20+, incluyendo los clones de células B patógenos. La duración de la depleción de células B suele ser de 6 a 12 meses. RTX también puede reducir la proteinuria al estabilizar la expresión de la esfingomielina-fosfodiesterasa-ácido-similar-3b en los podocitos, lo que disminuye la alteración del citoesqueleto de actina y la apoptosis. [5, 6]
Además de los estudios observacionales, varios ECAs han investigado la eficacia de RTX en NM. GEMRITUX fue un ECA que comparó RTX (2 dosis semanales de 375 mg/m2) combinado con TANI versus TANI solo. A los 6 meses, RTX no mostró diferencias en comparación con TANI para la remisión completa (RC) + remisión parcial (RP) (35% vs 21%). En el seguimiento ampliado de 17 meses, RTX fue superior a TANI (RC 19% frente a 3%, RC+RP 65% frente a 35%).[8] MENTOR fue un ECA de no inferioridad que comparó RTX (1 g los días 1 y 15, repetido a los 6 meses en pacientes que mostraron una reducción >25% en la proteinuria a los 6 meses) frente a ciclosporina A (CSA, 3.5 mg/kg/d durante 6-12 meses). El resultado compuesto primario fue RC o RP a los 24 meses. RTX mostró superioridad (60%) en comparación con CSA (20%).[8] Naik et al. hicieron un reporte de 33 pacientes tratados con RTX con alto riesgo inmunológico (título anti-PLA2R >150 RU/ml) y los compararon con 33 pacientes tratados con CYC/GC cíclico en pacientes con alto riesgo inmunológico. 23 pacientes (69.7%) recibieron RTX 1 g los días 1 y 15, 2 (6.1%) terapia dirigida a CD-19 y 8 (24.2%) 375 mg/m2. No hubo diferencia en la tasa de remisión a los 18 meses entre el grupo RTX (53.1 %) y el grupo CYC/GC cíclico (65.6%), aunque el último grupo tuvo cuatro veces más eventos adversos que los que recibieron RTX; sin embargo, la mayoría fueron menores y no hubo diferencia en los efectos adversos graves (EAG). [9]
El RTX ha demostrado eficacia a corto, mediano y largo plazo, baja incidencia de recaídas y un perfil aceptable de efectos adversos graves; por ello, el RTX puede ser la primera opción de tratamiento en la mayoría de los pacientes.
En los casos en los que la respuesta al RTX es subóptima, se debe considerar la resistencia al fármaco por dosificación insuficiente debido a la pérdida de RTX por proteinuria, el desarrollo de anticuerpos antifármaco o el desarrollo de mecanismos protectores de células B. Estos pacientes podrían requerir un ajuste de dosis y frecuencia, un cambio de tratamiento a agentes anti-CD20 humanizados o la adición de ICN o la sustitución por CYC y esteroides. Boyer-Sauvet et al. hicieron un reporte sobre su experiencia en el tratamiento exitoso de tres pacientes con anticuerpos anti-rituximab con ofatumumab.[10] Klomjit-Fervenza-Zand reportaron sobre su experiencia con el uso de Obinutuzumab en tres casos con MN refractaria asociada a PLA2R que indujo una remisión inmunológica completa en los tres pacientes (PLA2R <2 RU/mL en dos pacientes y 5 RU/mL en un paciente).[11]
Ciclofosfamida: experiencia a largo plazo
La CYC es un profármaco, cuyo agente alquilante activo es la mostaza fosforamida. Acelera la apoptosis de células T y B y reduce la producción de anticuerpos.5,6 Los agentes alquilantes y los GC fueron el pilar del tratamiento para la MN en las últimas décadas; demostraron ser superiores al tratamiento de terapia de soporte para reducir la proteinuria y prevenir la enfermedad renal crónica, como lo demostraron Ponticelli et al y Jha V et al. [4, 12] El seguimiento a largo plazo de los pacientes confirmó los beneficios mencionados de los agentes alquilantes más GC. La desventaja tradicional de usarlos ha sido el efecto adverso grave a corto y largo plazo, pero estudios recientes informaron su seguridad comparable a la de otros regímenes. El ECA STARMEN comparó un curso de inducción de 6 meses con tacrolimus (+ 3 meses de reducción gradual) + RTX (1 g dosis única en el mes 6) versus el régimen Ponticelli modificado (GC (meses 1.3 y 5) y CYC (meses 2.4 y 6), el resultado primario fue RC o RP a los 24 meses. El régimen CYC + GC fue superior al tratamiento secuencial con tacrolimus + RTX para lograr RC + RP y RC a los 24 meses de seguimiento (84% vs 58% y 60% vs 26% respectivamente), aunque no hubo diferencias en pacientes con función renal preservada. No hubo diferencias en los EAG entre los grupos (19% vs 14%). [13]
RI-CYCLO fue un ECA que comparó RTX (1 g en los días 1 y 15) versus el régimen cíclico (régimen Ponticelli modificado). El resultado primario fue RC a los 12 meses, en el que el régimen cíclico fue superior a RTX (32% vs 16%); aunque no mostró diferencias a los 24 meses de RC y SAE fueron similares a los 12 meses.[14] Recientemente, Zonozi et al reportaron una serie de casos retrospectiva unicéntrica de 60 pacientes tratados con una combinación de RTX (1 g en los días 1 y 15; y meses 4, 8, 12, 16, 20 y 24) + CYC (2.5 mg/kg oral todos los días durante la semana 1; 1.5 mg/kg oral todos los días durante las semanas 2-8) + GC. Los resultados primarios fueron RP y RC, la mediana de seguimiento fue de 38 meses. El 100% de los pacientes lograron RP, un tiempo medio de 3.4 meses; el 83% de los pacientes lograron RC, un tiempo medio de 12.4 meses. Aunque no todos los pacientes alcanzaron la RC, todos los pacientes tuvieron remisión inmunológica (anti-PLA2R sérico <14 RU/mL) a los 6 meses en comparación con el 92% en el ensayo STARMEN. El evento adverso más común observado fue la neutropenia de aparición tardía. [15]
ICN: eficaces pero con alto riesgo de recaídas
Los ICN tienen efectos inmunosupresores y antiproteinúricos. Los ICN inhiben las células T, se unen a las proteínas de señalización dependientes de la calcineurina que inician la transcripción génica de las células T necesaria para su activación y proliferación. En los podocitos, bloquean la desfosforilación de la sinaptopodina dependiente de la calcineurina, impidiendo la degradación mediada por la catepsina y preservando el citoesqueleto de actina. [5, 6] Praga et al. demostraron una alta tasa de remisión del síndrome nefrótico en comparación con la terapia de soporte; no obstante, los ICN tienen recaídas frecuentes después de la retirada.[16] En el estudio MENTOR, se reportó de una recaída del 52.9% en pacientes con CSA en comparación con el 5.1% en pacientes con RTX. [8] Por lo tanto, pueden ser útiles en combinación con RTX en pacientes con un perfil de alto riesgo, como se demostró en el ECA STARMEN.

Figura 3. Comparación de opciones de tratamiento inmunosupresor en Nefropatía Membranosa. Adaptado de: Rojas-Rivera, J. E., Ortiz, A., & Fervenza, F. C.. Novel Treatments Paradigms: Membranous Nephropathy. Kidney Int Rep. 2023 Jan 2;8(3):419-431.
¿Qué pasa con otros medicamentos?
El micofenolato de mofetilo (MMF) se ha utilizado en el pasado, pero no se recomienda ya que no ha demostrado beneficio sobre el TANI. [17] El belimumab es un anticuerpo monoclonal humano que se une a la proteína soluble estimulante de los linfocitos B, bloqueando la unión a los receptores de las células B. [6] Barrett et al. reportaron un estudio prospectivo abierto con 14 pacientes con MN, donde el belimumab (10 mg/kg/mes durante 104 semanas) indujo una RC + RP en 9 pacientes (64%), se observó una reducción de la proteinuria a partir de la semana 36 y anti-PLA2R a partir de la semana 12. [18] Actualmente, existen varios estudios clínicos dirigidos a las células plasmáticas (inhibidores del proteasoma y agentes anti-CD38) y la inhibición del sistema del complemento para el tratamiento de pacientes con MN. [6]
Conclusiones
El tratamiento de la MN se centra en la estratificación del riesgo, que tiene en cuenta el deterioro progresivo de la función renal y las complicaciones derivadas del síndrome nefrótico. La terapia inmunosupresora se reserva principalmente para pacientes clasificados como de riesgo alto o muy alto. A la hora de determinar el tratamiento inmunosupresor más adecuado, es fundamental lograr un equilibrio entre los posibles beneficios, los efectos adversos y los recursos locales disponibles.
El arsenal actual de opciones de tratamiento comprende predominantemente rituximab, agentes alquilantes en combinación con GC y/o ICN. Además, la investigación en curso sobre nuevos antígenos diana y nuevas clasificaciones sigue dando forma al enfoque del tratamiento, ofreciendo vías prometedoras para seguir mejorando los resultados de los pacientes.
| Referencias |
|---|
| 1. Troyanov, S., Wall, C. A., Miller, J. A., Scholey, J. W., & Cattran, D. C. (2004). Idiopathic membranous nephropatliy: Definition and relevance of a partial remission. Kidney International, 66(3), 1199–1205. https://doi.org/10.1111/j.1523-1755.2004.00873.x |
| 2. Rovin, B. H., Adler, S. G., Barratt, J., Bridoux, F., Burdge, K. A., Chan, T. M., Cook, H. T., Fervenza, F. C., Gibson, K. L., Glassock, R. J., Jayne, D. R. W., Jha, V., Liew, A., Liu, Z. H., Mejía-Vilet, J. M., Nester, C. M., Radhakrishnan, J., Rave, E. M., Reich, H. N., … Floege, J. (2021). KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney International, 100(4), S1–S276. https://doi.org/10.1016/j.kint.2021.05.021 |
| 3. A Controlled Study of Short-Term Prednisone Treatment in Adults with Membranous Nephropathy. (1979). New England Journal of Medicine, 301(24), 1301–1306. https://doi.org/10.1056/NEJM197912133012401 |
| 4. Ponticelli, C., Zucchelli, P., Passerini, P., Cesana, B., Locatelli, F., Pasquali, S., Sasdelli, M., Redaelli, B., Grassi, C., Pozzi, C., Bizzarri, D., & Banfi, G. (1995). A 10-year follow-up of a randomized study with methylprednisolone and chlorambucil in membranous nephropathy. Kidney International, 48(5), 1600–1604. https://doi.org/10.1038/ki.1995.453 |
| 5. Kant, S., Kronbichler, A., & Geetha, D. (2022). Principles of Immunosuppression in the Management of Kidney Disease: Core Curriculum 2022. In American Journal of Kidney Diseases (Vol. 80, Issue 3, pp. 393–405). W.B. Saunders. https://doi.org/10.1053/j.ajkd.2021.12.011 |
| 6. Rojas-Rivera, J. E., Ortiz, A., & Fervenza, F. C. (2023). Novel Treatments Paradigms: Membranous Nephropathy. In Kidney International Reports (Vol. 8, Issue 3, pp. 419–431). Elsevier Inc. https://doi.org/10.1016/j.ekir.2022.12.011 |
| 7. Dahan, K., Debiec, H., Plaisier, E., Cachanado, M., Rousseau, A., Wakselman, L., Michel, P. A., Mihout, F., Dussol, B., Matignon, M., Mousson, C., Simon, T., & Ronco, P. (2017). Rituximab for severe membranous nephropathy: A 6-month trial with extended follow-up. Journal of the American Society of Nephrology, 28(1), 348–358. https://doi.org/10.1681/ASN.2016040449 |
| 8. Fervenza, F. C., Appel, G. B., Barbour, S. J., Rovin, B. H., Lafayette, R. A., Aslam, N., Jefferson, J. A., Gipson, P. E., Rizk, D. V., Sedor, J. R., Simon, J. F., McCarthy, E. T., Brenchley, P., Sethi, S., Avila-Casado, C., Beanlands, H., Lieske, J. C., Philibert, D., Li, T., … Cattran, D. C. (2019). Rituximab or Cyclosporine in the Treatment of Membranous Nephropathy. New England Journal of Medicine, 381(1), 36–46. https://doi.org/10.1056/nejmoa1814427 |
| 9. Naik, S., Pal, D., Shukla, S., Kumar, V., Kumar, A., Jha, V., Minz, R., Sethi, J., Bharati, J., Divyaveer, S., Kumar, V., Rathi, M., Kohli, H. S., & Ramachandran, R. (2023). Rituximab in Patients With Primary Membranous Nephropathy With High Immunologic risk. Kidney International Reports. https://doi.org/10.1016/j.ekir.2023.05.009 |
| 10. Boyer-Suavet, S., Andreani, M., Lateb, M., Savenkoff, B., Brglez, V., Benzaken, S., Bernard, G., Nachman, P. H., Esnault, V., & Seitz-Polski, B. (2020). Neutralizing Anti-Rituximab Antibodies and Relapse in Membranous Nephropathy Treated With Rituximab. Frontiers in Immunology, 10. https://doi.org/10.3389/fimmu.2019.03069 |
| 11. Klomjit, N., Fervenza, F. C., & Zand, L. (2020). Successful Treatment of Patients With Refractory PLA2R-Associated Membranous Nephropathy With Obinutuzumab: A Report of 3 Cases. American Journal of Kidney Diseases, 76(6), 883–888. https://doi.org/10.1053/j.ajkd.2020.02.444 |
| 12. Jha, V., Ganguli, A., Saha, T. K., Kohli, H. S., Sud, K., Gupta, K. L., Joshi, K., & Sakhuja, V. (2007). A randomized, controlled trial of steroids and cyclophosphamide in adults with nephrotic syndrome caused by idiopathic membranous nephropathy. Journal of the American Society of Nephrology, 18(6), 1899–1904. https://doi.org/10.1681/ASN.2007020166 |
| 13. Fernández-Juárez, G., Rojas-Rivera, J., Logt, A. E. van de, Justino, J., Sevillano, A., Caravaca-Fontán, F., Ávila, A., Rabasco, C., Cabello, V., Varela, A., Díez, M., Martín-Reyes, G., Diezhandino, M. G., Quintana, L. F., Agraz, I., Gómez-Martino, J. R., Cao, M., Rodríguez-Moreno, A., Rivas, B., … Hofstra, J. (2021). The STARMEN trial indicates that alternating treatment with corticosteroids and cyclophosphamide is superior to sequential treatment with tacrolimus and rituximab in primary membranous nephropathy. Kidney International, 99(4), 986–998. https://doi.org/10.1016/j.kint.2020.10.014 |
| 14. Scolari, F., Delbarba, E., Santoro, D., Gesualdo, L., Pani, A., Dallera, N., Mani, L. Y., Santostefano, M., Feriozzi, S., Quaglia, M., Boscutti, G., Ferrantelli, A., Marcantoni, C., Passerini, P., Magistroni, R., Alberici, F., Ghiggeri, G. M., Ponticelli, C., & Ravani, P. (2021). Rituximab or Cyclophosphamide in the Treatment of Membranous Nephropathy: The RI-CYCLO Randomized Trial. Journal of the American Society of Nephrology, 32(4), 972–982. https://doi.org/10.1681/ASN.2020071091 |
| 15. Zonozi, R., Laliberte, K., Huizenga, N. R., Rosenthal, J. K., Jeyabalan, A., Collins, A. B., Cortazar, F. B., & Niles, J. L. (2021). Combination of Rituximab, Low-Dose Cyclophosphamide, and Prednisone for Primary Membranous Nephropathy: A Case Series With Extended Follow Up. American Journal of Kidney Diseases, 78(6), 793–803. https://doi.org/10.1053/j.ajkd.2021.04.014 |
| 16. Praga, M., Barrio, V., Juárez, G. F., & Luño, J. (2007). Tacrolimus monotherapy in membranous nephropathy: A randomized controlled trial. Kidney International, 71(9), 924–930. https://doi.org/10.1038/sj.ki.5002215 |
| 17. Dussol, B., Morange, S., Burtey, S., Indreies, M., Cassuto, E., Mourad, G., Villar, E., Pouteil-Noble, C., Karaaslan, H., Sichez, H., Lasseur, C., Delmas, Y., Nogier, M. B., Fathallah, M., Loundou, A., Mayor, V., & Berland, Y. (2008). Mycophenolate Mofetil Monotherapy in Membranous Nephropathy: A 1-Year Randomized Controlled Trial. American Journal of Kidney Diseases, 52(4), 699–705. https://doi.org/10.1053/j.ajkd.2008.04.013 |
| 18. Barrett, C., Willcocks, L. C., Jones, R. B., Tarzi, R. M., Henderson, R. B., Cai, G., Gisbert, S. I., Belson, A. S., & Savage, C. O. (2020). Effect of belimumab on proteinuria and anti-phospholipase A2 receptor autoantibody in primary membranous nephropathy. Nephrology Dialysis Transplantation, 35(4), 599–606. https://doi.org/10.1093/ndt/gfz086 |
