Nefropatía por IgA: de la Fisiopatología de los Cuatro Golpes a las Nuevas Terapias Emergentes

Por: Dra. Sandra Gabriela Carias-Zuñiga
Nefróloga en Kaiser Permanente, California
Fellow en GlomCon Glomerular Disease Fellowship
Fremont, CA, Estados Unidos / Honduras
X: DrCariasZ

Por: Dra. María Fernanda Zavala
Médico Internista/Nefróloga
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán
Ciudad de México, México

Por: Dr. Alejandro García Rivera
Nefrólogo/ Nefrólogo Intervencionista
Hospital General Regional 46, IMSS
Guadalajara, México
X: AlexGR23
INTRODUCCIÓN
La nefropatía por inmunoglobulina A (IgAN) es el patrón más común de enfermedad glomerular primaria a nivel mundial. Los pacientes pueden presentar un amplio espectro de manifestaciones clínicas, desde hematuria aislada, síndrome nefrítico, síndrome nefrótico, hasta glomerulonefritis rápidamente progresiva. Por otra parte, estos pacientes presentan un alto riesgo de progresión a enfermedad renal crónica (ERC), debido a un mayor tiempo de evolución de la enfermedad al tener una presentación en la edad de adultos jóvenes. En el estudio RaDaR UK (UK Registry of Rare Diseases), se documentó que hasta el 80% de los pacientes progresaron a ERC en un periodo de tiempo de 30 años y el riesgo persistía a pesar de que los pacientes lograron proteinurias <1 gr/d. [1,2]
Durante mucho tiempo el tratamiento de la IgAN se había enfocado en el manejo de soporte renal por periodos de 3 a 6 meses. Únicamente aquellos pacientes con alto riesgo de progresión definido por la proteinuria persistente ≥1 gr y tasas de filtrado glomerular estimado (TFGe) >50 ml/min/1.73 m2 se les podría ofrecer un periodo de manejo con esteroides. [3,4]
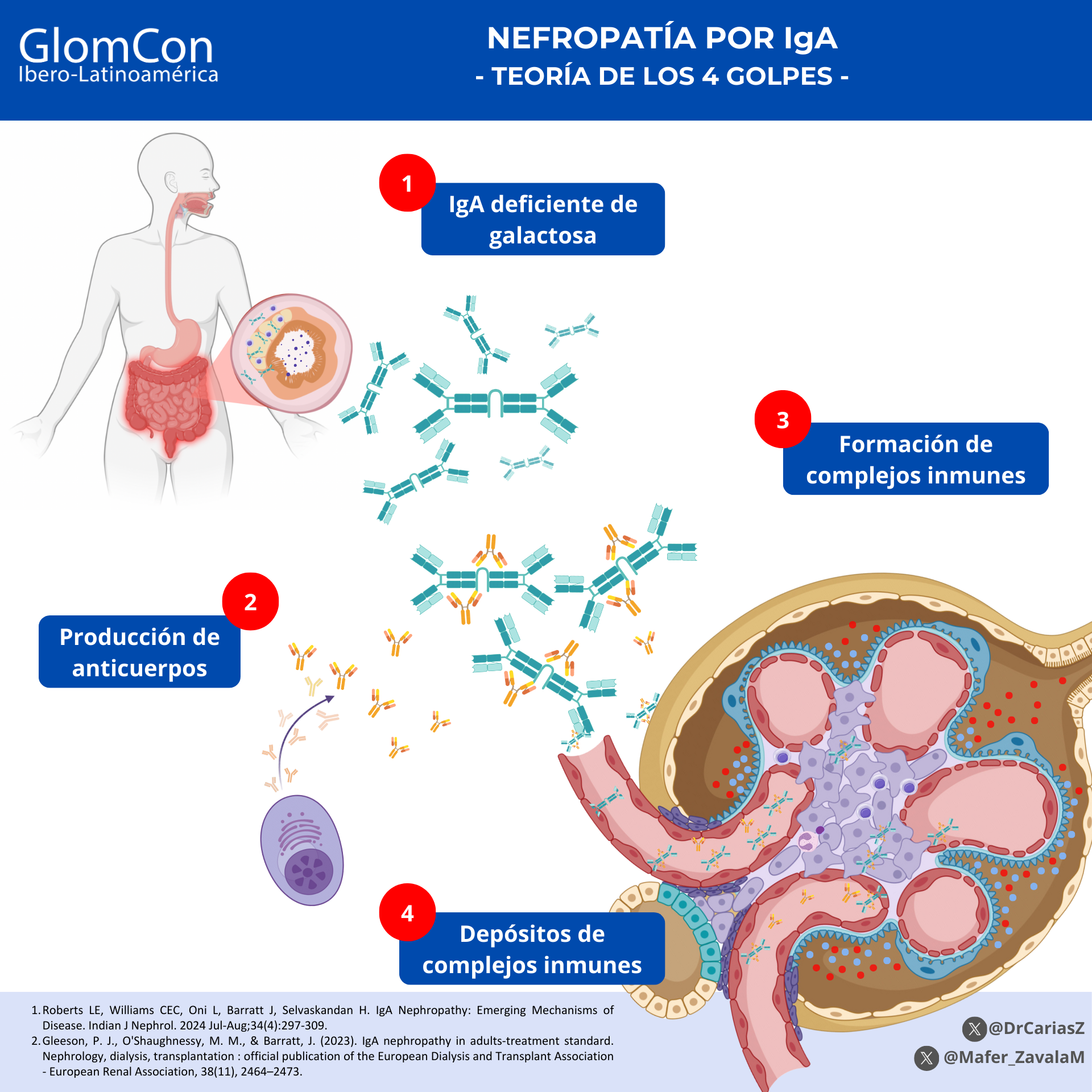
Sin embargo, la IgAN es una enfermedad autoinmune, cuya fisiopatología se explica por la teoría de los 4 golpes. Inicialmente, hay un aumento de los niveles séricos de IgA1 deficiente en galactosa (IgA1-dg) [Hit 1], seguido de la formación de autoanticuerpos contra la IgA-dg [Hit 2], que formarán complejos inmunes [Hit 3] y que posteriormente se depositarán dentro del mesangio [Hit 4] y esto desencadenará toda una cascada de inflamación que, de no tratarlo, resultará en deterioro de la función renal. (Figura 1). [5-6]
El tratamiento ha evolucionado en los últimos años y se ha destacado la importancia del manejo inmunológico de esta enfermedad, basado desde la fisiopatología de los 4 golpes, los cuales representan posibles objetivos terapéuticos específicos. Actualmente contamos con un arsenal de nuevos medicamentos, cuya finalidad es el control de la enfermedad autoinmune, reducción de la proteinuria y disminución de la pérdida de tasa de filtrado glomerular.
Esta revisión tiene como objetivo resumir los avances y actualizaciones en las estrategias terapéuticas en la IgAN y resaltar los descubrimientos prometedores que probablemente se sumarán a nuestro arsenal terapéutico.

Figura 1. Nefropatía por IgA. Teoría de los Cuatro Golpes.
ESTABLECIENDO EL OBJETIVO
DISMINUCIÓN PROTEINURIA
El objetivo del tratamiento en pacientes con IgAN en riesgo de pérdida progresiva de la función renal es reducir la proteinuria <1 g/d. [4] Sin embargo, con los últimos datos basados en el estudio RaDaR y ensayos clínicos, se ha planteado que la proteinuria sea lo más bajo posible para evitar este umbral de proteinuria, debido a que los pacientes con <0.88 g/d (o equivalente) de proteinuria tienen un riesgo de progresión a ERC del 30%. Por lo que es preferible mantenerlos con proteinurias <0.3 g/d, tomando en cuenta que en algunos pacientes con cicatrices renales extensas puede no ser posible esta meta. [4]
ESTABILIZACIÓN DE LA TASA FILTRADO GLOMERULAR
Se busca estabilizar la pérdida anual de TFGe, que no exceda 1 ml/min al año en pacientes con IgA. En el estudio del Reino Unido se describió que en pacientes entre 18-30 años con la pérdida de 1 ml/min/1.73m2 al año progresarán a ERC KDIGO G5 antes de los 50 años hasta un 40%, por lo que es importante apuntar a una menor pérdida de tasa de filtrado glomerular. [2]
DESAPARICIÓN HEMATURIA:
La hematuria se ha considerado un factor de riesgo importante para progresión a ERC. En el estudio de Sevilla et al. se demostró que los pacientes con proteinurias >0.75 g/d y hematuria persistente presentaron un peor pronóstico renal. [7] En el estudio NefIgArd se demostró que la desaparición de la hematuria es una meta potencialmente alcanzable. [8]
Por lo que enfoque del manejo en la mayoría de los pacientes debería ser: reducir simultáneamente la excreción de proteínas en la orina, controlar la presión arterial y tratar de evitar el daño adicional al riñón, utilizando las intervenciones farmacológicas adecuadas y modificando los factores de riesgo.
PUNTOS CLAVE:
- Prevenir o reducir la formación de complejos inmunes de IgA y la lesión glomerular mediada por éstos, incorporando tratamientos con efectos antiinflamatorios probados. Lo ideal es que se utilicen en combinación con tratamientos que previenen o reducen la formación de complejos inmunes de IgA. [9]
• Gestionar en paralelo las consecuencias de la pérdida de nefronas inducida por la IgAN existente. [9]

Figura 2. Enfoque multisistémico para dirigirse a las vías patogénicas, además de la atención de apoyo óptima
MEDIDAS PARA REDUCIR LA HIPERFILTRACIÓN GLOMERULAR
Las medidas para reducir la hiperfiltración glomerular y el impacto de la proteinuria sobre el túbulo-intersticio, incluyen, de forma individual o combinada: bloqueo del sistema renina-angiotensina (RAS), inhibición del cotransportador de sodio-glucosa 2 (iSGLT2) o los antagonistas duales del receptor de endotelina y angiotensina II tipo 1. [10]
Los inhibidores del sistema renina-angiotensina (RASi) reducen eficazmente la proteinuria y cuentan con amplios datos de eficacia y seguridad en la enfermedad renal crónica (ERC) y las enfermedades cardiovasculares. [10]
El uso de sparsentan, un antagonista dual del receptor de endotelina-1 y angiotensina II tipo 1 (ETAR), es el único fármaco que ha demostrado eficacia más allá de los inhibidores del sistema renina-angiotensina (RASi) en los ensayos clínicos. El efecto de bloquear el receptor de endotelina-1 disminuye la vasoconstricción intrarrenal, la inflamación, proliferación celular y por lo tanto presenta un efecto anti-fibrótico. En el estudio PROTECT se documentó una disminución importante en la proteinuria y disminuye de manera importante la disminución de la TFGe. Por lo que la Food and Drug Administration (FDA) aprobó su uso para IgAN. Recientemente se publicó el estudio ALIGN con atrasentan donde se demostró su seguridad y eficacia. [11,12]
Se ha demostrado que los inhibidores del cotransportador de sodio-glucosa 2 (SGLT2i) no solo reducen la tasa de progresión de la pérdida de función renal, sino que también reducen la incidencia de eventos cardiovasculares adversos, especialmente en personas con diabetes. En los estudios DAPA-CKD y EMPAKIDNEY se incluyó una población importante de pacientes con IgAN que fue valorado en análisis post-hoc donde se observó disminución de la albuminuria en comparación del uso de RASi como monoterapia. Actualmente se está valorando el uso conjunto de un antagonista dual, un ETAR con un iSGLT2 en el estudio SPARTACUS (NCT05856760). [13-15]
MEDIDAS PARA DETENER LA INFLAMACIÓN GLOMERULAR
Existen varios fármacos en desarrollo cuyos mecanismos de acción buscan reducir los niveles de formas patogénicas de IgA y complejos inmunes de IgA en la circulación, ya sea mediante la depleción de células B/células plasmáticas o la modulación de la función de éstas mismas.
Nefecon presenta una forma de budesónida de liberación dirigida a las placas de Peyer, localizadas en el íleo terminal. Es uno de los tratamientos que hasta la fecha ha demostrado reducir los niveles de formas patogénicas de IgA y complejos inmunes de IgA. Asimismo demostró disminución de la proteinuria hasta el 50% y la TFGe se estabilizó a 9 meses, sin presentar efectos adversos graves como los esteroides sistémicos. Fue aprobado por la FDA en 2024. [16,17]
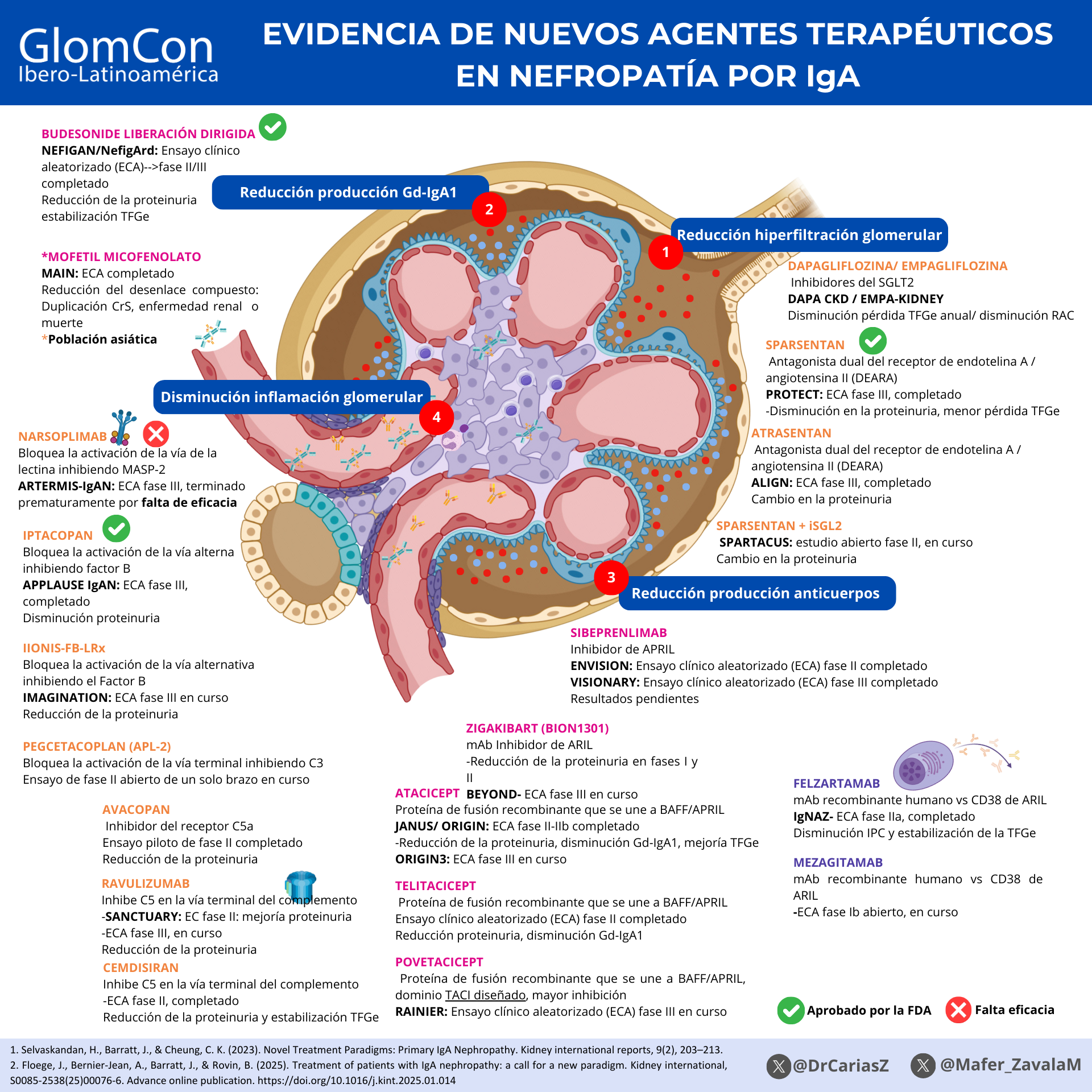
Figura 3. Evidencia de nuevos agentes terapéuticos en Nefropatía por IgA.
INHIBICIÓN DEL COMPLEMENTO
La activación del complemento juega un papel importante en la fisiopatología de IgAN, tanto en la inflamación glomerular como en el daño túbulo-intersticial. Se ha observado la presencia de proteínas del complemento de la vía alternativa y la vía de las lectinas.
La vía alternativa del complemento desempeña un papel fundamental en la nefropatía por IgA. Hasta el momento se encuentran múltiples fármacos en estudio dirigidos principalmente contra la activación del factor B. Iptacopan (LNP023) es un inhibidor oral del complemento, altamente potente, que se une específicamente al factor B e inhibe la vía alternativa. En el estudio APPLAUSE-IgAN se observó una reducción importante de la proteinuria en un 38% en comparación con el grupo placebo, con un adecuado perfil de seguridad. Por lo cual recibió la aprobación acelerada por la FDA para el uso en pacientes con IgAN. [18,19]
En cuanto a la vía de las lectinas, en algunos estudios se ha observado incremento de los niveles circulantes de lectina transportadora de manosa (MBL) y de serina proteasa-3 asociada a lectina de unión a mananosas (MASP-3) en pacientes con IgAN. Narsoplimab (OMS721) era un anticuerpo monoclonal IgG4 completamente humanizado inhibidor de MASP-2, la cual es una enzima importante en la vía de las lectinas. Narsoplimab se evaluó en el estudio ARTEMIS-IgAN (NCT03608033). Sin embargo, el ensayo se interrumpió, ya que el manejo con narsoplimab no alcanzó una reducción estadísticamente significativa de la proteinuria en comparación con placebo. [20-21]
Finalmente, en la vía común se está evaluando el inhibidor de C5 de acción prolongada llamado ravulizumab en IgAN. Inicialmente en el estudio fase II SANCTUARY se observó una reducción en la proteinuria del 30% en la semana 26 de tratamiento. Actualmente se está corriendo el estudio fase III (NCT06291376), aún pendientes los resultados. [9,18,22]
TERAPIAS DEPLETORAS DE CÉLULAS B
BLOQUEANDO A APRIL Y BAFF
El factor activador de células B de la familia TNF (BAFF; también conocido como BLyS) y el ligando inductor de proliferación (APRIL) son miembros de la superfamilia de ligandos del factor de necrosis tumoral α (TNF) que desempeñan papeles importantes en la maduración, supervivencia y proliferación de células B. [9]
BAFF es fundamental para la activación, supervivencia y diferenciación de las células B periféricas. APRIL también es necesario para la supervivencia y diferenciación de las células B en células plasmáticas. BAFF y APRIL se unen a dos receptores, el antígeno de maduración de células B (BCMA) y el activador transmembrana, modulador de calcio e interactor con el ligando de ciclofilina (TACI). BCMA se expresa principalmente en células plasmáticas, mientras que TACI se expresa en células B maduras y células plasmáticas activadas. Un tercer receptor, el receptor BAFF (BAFF-R), que es específico para BAFF, se expresa principalmente en las células B. [23]
Por lo que la doble inhibición de BAFF y APRIL ofrece una disminución en la producción de inmunoglobulina A galactosa deficiente, así como la formación de los autoanticuerpos que formarán los complejos inmunes. Lo cual es una estrategia terapéutica potencialmente modificadora de la enfermedad que podría retardar o detener la progresión de la IgAN.
Atacicept y telitacicept son proteínas de fusión en la región Fc de IgG1 del dominio extracelular TACI solubles que inhiben fuertemente BAFF e inhiben débilmente la señalización APRIL. [23] Han demostrado una reducción en la proteinuria y en los títulos de IgA1-gd, con un adecuado perfil de seguridad, a pesar de tener reducciones en otras inmunoglobulinas. En el estudio fase IIb ORIGIN con atacicept, además de una reducción en proteinuria, se reportó una mejoría de en la TFGe con una diferencia del 11% en comparación con placebo en la semana 36 de tratamiento. [24-25] Povetacicept es un nuevo agente que cuenta con un dominio TACI diseñado, lo cuál lo hace un potente inhibidor de BAFF y APRIL al tener una mayor afinidad de unión. Actualmente está siendo evaluado en el estudio RAINIER ( NCT06564142) fase 3 en pacientes adultos con IgAN. [26]
De la misma manera, se están estudiando anticuerpos dirigidos únicamente contra APRIL. Sibeprenlimab, es un anticuerpo monoclonal IgG2 humanizado que se une a APRIL y neutraliza su actividad. En el estudio fase II, ENVISION, se evaluó la eficacia y seguridad de diferentes dosis de sibeprelimab. Se observó una reducción de los niveles séricos de APRIL y los niveles de IgA-dg después de la administración IV del medicamento. Además de reducciones importantes de proteinuria y estabilización de la TFGe en comparación con placebo, particularmente con dosis más altas. [27] Por el momento, se encuentran pendientes los resultados del estudio fase III, VISIONARY (NCT05248646). Otro anticuerpo monoclonal inhibidor de APRIL en estudio es zigakibart. Se ha reportado en los ensayos clínicos fase I y II una reducción sostenida de los niveles séricos de IgA-gd y de los niveles de proteinuria con un perfil de seguridad aceptable. [28] Se encuentra en curso el estudio fase III de zigakibart, el estudio BEYOND (NCT05852938).
Finalmente se están llevando a cabo terapias dirigidas a las células plasmáticas. Felzartamab es un anticuerpo monoclonal humano que se dirige contra CD38 expresado en células plasmáticas. En el estudio de fase II IGNAZ se exploró la eficacia y seguridad de felzartamab en 54 pacientes con IgAN de alto riesgo. Durante un periodo de tratamiento de 6 meses se observó reducciones sustanciales en los niveles de proteinuria y estabilización de la función renal, dicho efecto se mantuvo por más de 18 meses desde la última dosis de felzartamab. Se planea el inicio de un estudio fase III en 2025 con felzartamab. [29]
No existen terapias aprobadas para detener las señales pro-fibróticas en el riñón en el horizonte, pero tenemos la esperanza de que se desarrollen nuevas estrategias terapéuticas en el futuro. [9]
En conclusión, la larga espera para una nueva era en el manejo de la nefropatía IgA (IgAN) podría estar por terminar, con nuevos tratamientos y biomarcadores pronto a estar a nuestra disposición para prevenir la progresión, reducir la carga de la enfermedad e incrementar la esperanza de vida de los pacientes con IgAN.
| Referencias |
|---|
| 1. Galla JH. IgA nephropathy. Kidney Int. 1995;47:377–387. https://doi.org/10.1038/ki.1995.50 |
| 2. Pitcher D, Braddon F, Hendry B, et al. Long-Term outcomes in IgA nephropathy. Clin J Am Soc Nephrol. 2023;18:727–738 |
| 3. Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO clinical practice guideline for glomerulonephritis. Kidney Int Suppl. 2012;2:139–274 |
| 4. Rovin BH, Adler SG, Barratt J et al. Executive summary of the KDIGO 2021 Guideline for the management of glomerular diseases. Kidney Int 2021;100:753–79. https://doi.org/10.1016/j.kint. 2021.05.015 |
| 5. Suzuki H, Kiryluk K, Novak J et al. The pathophysiology of IgA nephropathy. J Am Soc Nephrol 2011;22:1795–803. https://doi.org/ 10.1681/ASN.2011050464 |
| 6. Roberts LE, Williams CEC, Oni L, Barratt J, Selvaskandan H. IgA Nephropathy: Emerging Mechanisms of Disease. Indian J Nephrol. 2024 Jul-Aug;34(4):297-309. doi:10.25259/ijn_425_23. Epub 2024 Jun 24. PMID: 39156850; PMCID: PMC11326799 |
| 7. Sevillano AM, Gutierrez E, Yuste C, et al. Remission of hematuria improves renal survival in IgA nephropathy. J Am Soc Nephrol. 2017;28: 3089 3099 |
| 8. Lafayette R, Kristensen J, Stone A, et al. Efficacy and safety of a targeted-release formulation of budesonide in patients with primary IgA nephropathy (NefIgArd): 2-year results from a randomised phase 3 trial. Lancet. 2023;402:859–870 |
| 9. Floege J, Bernier-Jean A, Barratt J, Rovin B. Treatment of patients with IgA nephropathy: a call for a new paradigm. Kidney Int. Published online January 31, 2025. doi:10.1016/j.kint.2025.01.014 |
| 10. Rauen T, Eitner F, Fitzner C, et al. Intensive supportive care plus immunosuppression in IgA nephropathy. N Engl J Med. 2015;373:2225–2236 |
| 11. Heerspink HJL, Radhakrishnan J, Alpers CE, et al. Sparsentan in patients with IgA nephropathy: a prespecified interim analysis from a randomised, double-blind, active-controlled clinical trial. Lancet. 2023;401:1584–1594 |
| 12. Heerspink HJL, Jardine M, Kohan DE, et al. Atrasentan in patients with IgA nephropathy. N Engl J Med. Published online October 25, 2024. https://doi.org/10.1056/NEJMoa2409415 |
| 13. Nuffield Department of Population Health Renal Studies Group. SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists’ Consortium. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo- controlled trials. Lancet. 2022;400:1788–1801 |
| 14. EMPA-KIDNEY Collaborative Group. Impact of primary kidney disease on the effects of empagliflozin in patients with chronic kidney disease: secondary analyses of the EMPA-KIDNEY trial. Lancet Diabetes Endocrinol. 2024;12:51–60 |
| 15. Ayoub I, Tang S, Kooienga L, et al. Concomitant sparsentan and SGLT2 inhibitors in adults with IgA nephropathy in the ongoing phase 2 SPARTACUS trial (abstract). J Am Soc Nephrol. 2024;35 |
| 16. Wimbury D, Muto M, Bhachu JS, et al. Targeted-release budesonide modifies key pathogenic biomarkers in immunoglobulin A nephropathy:insights from the NEFIGAN trial. Kidney Int. 2024;105:381–388 |
| 17. Barratt, J., Lafayette, R., Kristensen, J., Stone, A., Cattran, D., Floege, J., Tesar, V., Trimarchi, H., Zhang, H., Eren, N., Paliege, A., Rovin, B. H., & NefIgArd Trial Investigators (2023). Results from part A of the multi-center, double-blind, randomized, placebo-controlled NefIgArd trial, which evaluated targeted-release formulation of budesonide for the treatment of primary immunoglobulin A nephropathy. Kidney international, 103(2), 391–402. https://doi-org.pbidi.unam.mx:2443/10.1016/j.kint.2022.09.017 |
| 18. Caravaca-Fontán, F., Gutiérrez, E., Sevillano, Á. M., & Praga, M. (2023). Targeting complement in IgA nephropathy. Clinical kidney journal, 16(Suppl 2), ii28–ii39. https://doi-org.pbidi.unam.mx:2443/10.1093/ckj/sfad198 |
| 19. Perkovic, V., Barratt, J., Rovin, B., Kashihara, N., Maes, B., Zhang, H., Trimarchi, H., Kollins, D., Papachristofi, O., Jacinto-Sanders, S., Merkel, T., Guerard, N., Renfurm, R., Hach, T., Rizk, D. V., & APPLAUSE-IgAN Investigators (2025). Alternative Complement Pathway Inhibition with Iptacopan in IgA Nephropathy. The New England journal of medicine, 392(6), 531–543. https://doi-org.pbidi.unam.mx:2443/10.1056/NEJMoa2410316 |
| 20. Barratt, J., Lafayette, R. A., Zhang, H., Tesar, V., Rovin, B. H., Tumlin, J. A., Reich, H. N., & Floege, J. (2023). IgA nephropathy: the lectin pathway and implications for targeted therapy. Kidney international, 104(2), 254–264. https://doi-org.pbidi.unam.mx:2443/10.1016/j.kint.2023.04.029 |
| 21. Lafayette, R. A., Rovin, B. H., Reich, H. N., Tumlin, J. A., Floege, J., & Barratt, J. (2020). Safety, Tolerability and Efficacy of Narsoplimab, a Novel MASP-2 Inhibitor for the Treatment of IgA Nephropathy. Kidney international reports, 5(11), 2032–2041. https://doi-org.pbidi.unam.mx:2443/10.1016/j.ekir.2020.08.003 |
| 22. Lafayette, R., Tumlin, J., Fenoglio, R., Kaufeld, J., Pérez Valdivia, M. Á., Wu, M. S., Susan Huang, S. H., Alamartine, E., Kim, S. G., Yee, M., Kateifides, A., Rice, K., Garlo, K., Barratt, J., & SANCTUARY Study Investigators (2024). Efficacy and Safety of Ravulizumab in IgA Nephropathy: A Phase 2 Randomized Double-Blind Placebo-Controlled Trial. Journal of the American Society of Nephrology : JASN, 10.1681/ASN.0000000534. Advance online publication. https://doi.org/10.1681/ASN.0000000534 |
| 23. Cheung, C. K., Barratt, J., Liew, A., Zhang, H., Tesar, V., & Lafayette, R. (2024). The role of BAFF and APRIL in IgA nephropathy: pathogenic mechanisms and targeted therapies. Frontiers in nephrology, 3, 1346769. https://doi-org.pbidi.unam.mx:2443/10.3389/fneph.2023.1346769 |
| 24. Lv, J., Liu, L., Hao, C., Li, G., Fu, P., Xing, G., Zheng, H., Chen, N., Wang, C., Luo, P., Xie, D., Zuo, L., Li, R., Mao, Y., Dong, S., Zhang, P., Zheng, H., Wang, Y., Qin, W., Wang, W., … Zhang, H. (2022). Randomized Phase 2 Trial of Telitacicept in Patients With IgA Nephropathy With Persistent Proteinuria. Kidney international reports, 8(3), 499–506. https://doi-org.pbidi.unam.mx:2443/10.1016/j.ekir.2022.12.014 |
| 25. Lafayette R, Maes B, Lin C, Barbour S, Phoon R, Kim SG, et al. 3848 ORIGIN trial: 24-wk primary analysis of a randomized, double-blind, placebo-controlled ph2b study of atacicept in patients with IgAN. Nephrol Dial Transplant (2023) 38:gfad063a. doi: 10.1093/ndt/gfad063a_3848 |
| 26. Tumlin, J., et al. (2024). WCN24-762 updated results from the RUBY-3 study of povetacicept, an enhanced dual BAFF/APRIL antagonist, in autoantibody-associated glomerulonephritis. Kidney International Reports, 9(4), S505 |
| 27. Mathur, M., Barratt, J., Chacko, B., Chan, T. M., Kooienga, L., Oh, K. H., Sahay, M., Suzuki, Y., Wong, M. G., Yarbrough, J., Xia, J., Pereira, B. J. G., & ENVISION Trial Investigators Group (2024). A Phase 2 Trial of Sibeprenlimab in Patients with IgA Nephropathy. The New England journal of medicine, 390(1), 20–31. https://doi-org.pbidi.unam.mx:2443/10.1056/NEJMoa2305635 |
| 28. Yeo, S. C., & Barratt, J. (2023). The contribution of a proliferation-inducing ligand (APRIL) and other TNF superfamily members in pathogenesis and progression of IgA nephropathy. Clinical kidney journal, 16(Suppl 2), ii9–ii18. https://doi-org.pbidi.unam.mx:2443/10.1093/ckj/sfad200 |
| 29. Barratt, J., Floege, J., Lafayette, R. A., Schwartz, B. M., Patel, U. D., Manser, P., Kivman, L., Haertle, S., Faulhaber, N., Thakur, A. G., & Barbour, S. (2024). Felzartamab for IgA nephropathy: Final results of the IGNAZ study: SA-OR101. Journal of the American Society of Nephrology, 35(10S), 10.1681/ASN.2024s6p6remb. https://doi.org/10.1681/ASN.2024s6p6remb |
