Caso Clínico: Trombocitopenia y Síndrome Nefrítico

Por: Dr. Javier Soto Vargas
Nefrólogo
Hospital General Regional 46, IMSS
Hospital Civil de Guadalajara, Juan I. Menchaca
Guadalajara, México
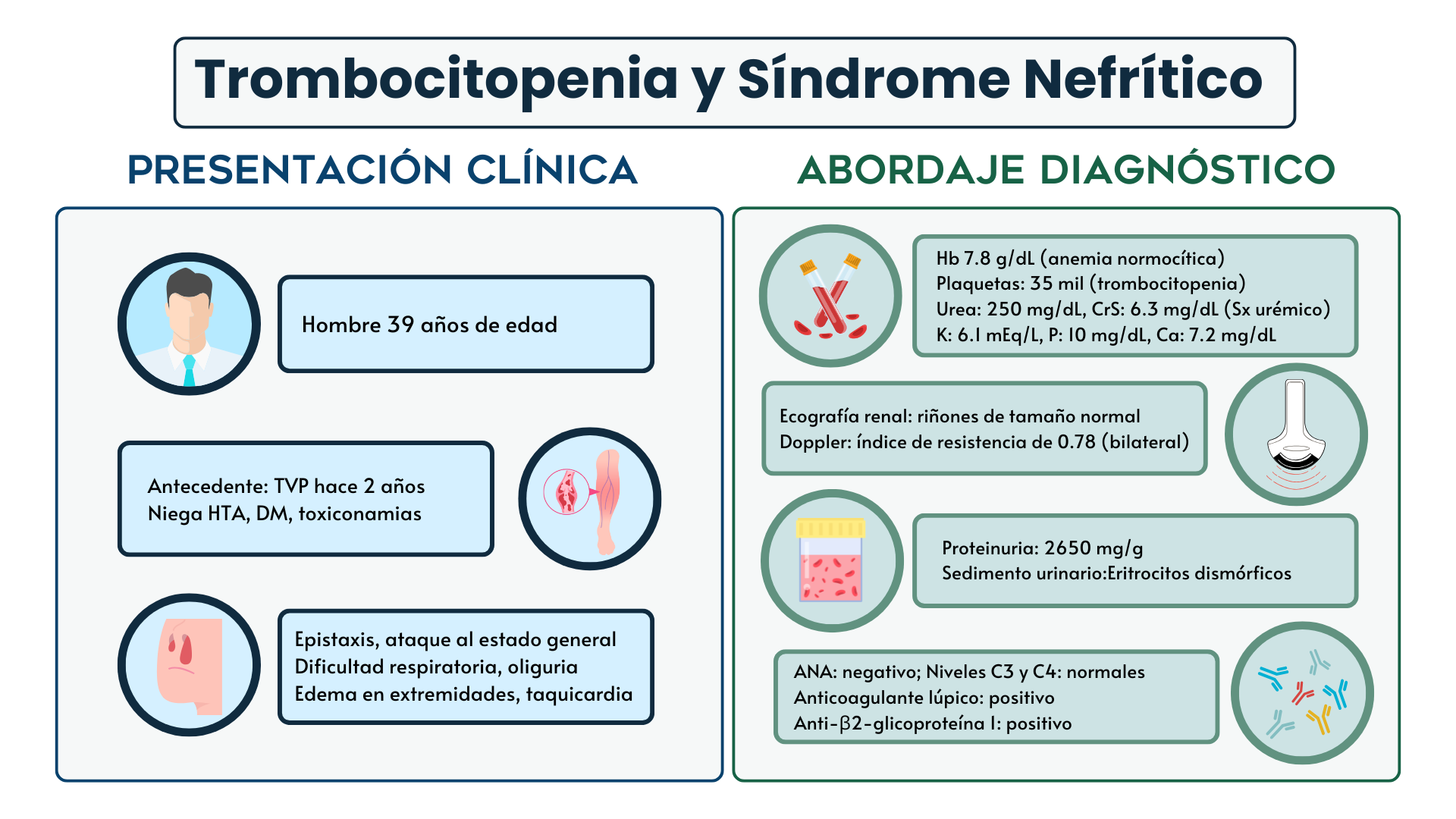
Un hombre de 39 años, previamente sano, fue ingresado al hospital por ataque al estado general, epistaxis y dificultad respiratoria. A su llegada, presentó taquicardia sinusal, palidez generalizada, edema en las extremidades y oliguria. Los estudios iniciales revelaron anemia normocítica con hemoglobina de 7.8 g/dL, trombocitopenia severa de 35 mil plaquetas y leucocitos normales (6700). Además, la bioquímica evidenció un síndrome urémico grave con urea de 250 mg/dL, creatinina de 6.3 mg/dL, hiperkalemia (potasio 6.1), hiperfosfatemia (fosfato 10) e hipocalcemia (calcio 7.2), junto con acidemia metabólica severa (bicarbonato de 8, pCO2 de 12 mmHg).
El estudio inicial para determinar la causa de su lesión renal aguda mostró hematuria glomerular y proteinuria de 2650 mg/g, sin alteraciones significativas en el ultrasonido renal, pero con un índice de resistencia elevado (0.78) en las arterias arcuatas de ambos riñones. Frotis sanguíneo sin evidencia de hemólisis. Niveles normales de DHL (250 U/L), haptoglobinas 65 mg/dL, bilirrubina total de 0.8 mg/dL y Coombs directo negativo, lo que descartó anemia hemolítica de origen inmune. También se descartó la posibilidad de microangiopatía trombótica como causa subyacente.

A pesar de los esfuerzos iniciales con esteroides a dosis altas y terapia de reemplazo renal, la trombocitopenia del paciente persistió, con recuentos que llegaron a 3 mil plaquetas, requiriendo transfusiones frecuentes. En cuanto al estudio de las causas inmunológicas, los anticuerpos antinucleares (ANAs) resultaron negativos en dos ocasiones, descartando lupus eritematoso sistémico, al igual que el complemento (C3 y C4) que se encontraba dentro de los límites normales. Además, se descartaron infecciones virales como hepatitis B, hepatitis C y VIH, todas con serologías negativas.
El diagnóstico de síndrome antifosfolípidos (SAF) fue sospechado tras la detección de anticoagulante lúpico y anticuerpos anti-β2 glicoproteína I positivos. Con este diagnóstico, se decidió iniciar plasmaféresis, administrando cuatro sesiones sin una mejora significativa en el recuento plaquetario, que no superó las 40 mil plaquetas. Dado el limitado éxito de la plasmaféresis, se añadió rituximab al esquema de tratamiento, lo que resultó en una mejora significativa del estado clínico y el recuento plaquetario, que finalmente se estabilizó por encima de 100 mil.
Tres semanas después del ingreso, el paciente continuaba en hemodiálisis, pero con un recuento plaquetario estabilizado, lo que permitió realizar una biopsia renal percutánea sin complicaciones. Los hallazgos histopatológicos confirmaron la presencia de una nefropatía asociada a síndrome antifosfolípidos (SAF), caracterizada por vasculopatía crónica de tipo microangiopatía trombótica sin trombos visibles, glomeruloesclerosis global y difusa en el 80% de los glomérulos, y alteraciones compatibles con hipoperfusión glomerular y glomerulomegalia. También se identificó una tubulopatía aguda de tipo isquémico, nefritis túbulo intersticial crónica leve con infiltrado linfoplasmocitario, atrofia tubular y fibrosis intersticial moderada (IFTA2), junto con arterioesclerosis moderada y arteriolas con cambios de “tela de cebolla” y luces puntiformes.

Panel A y B: Tinción de PAS donde se observa en arteriolas y pequeñas arterias se observan fibrosis intimal con disminución del lumen, con laminación concéntrica que le da la apariencia de “aros de cebolla” que incluso cierra por completo la luz del vaso.

Panel C y D: Tinción de Jones en donde se observan asas capilares corrugadas, con membranas basales engrosadas, de manera segmentaria se observa formación de nueva membrana basal hacia el lado endotelial dando la apariencia de dobles contornos
El diagnóstico final fue síndrome antifosfolípido (SAF) con nefropatía asociada, responsable tanto de la afectación renal como de la trombocitopenia severa. El tratamiento con rituximab fue clave en la estabilización del paciente, aunque continuó requiriendo soporte renal.
Epidemiología, Historia y Definición
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune caracterizada por la presencia de autoanticuerpos y alteraciones en el sistema de coagulación. Se considera una enfermedad rara, aunque es probable que su prevalencia esté subestimada. Se estima que afecta entre 20 y 50 personas por cada 100.000 [1].
La nefropatía asociada a SAF (NASAF), un subtipo del SAF que afecta específicamente a los riñones, se describió por primera vez a principios de la década de 1990 [2]. Se caracteriza por una serie de lesiones renales, que incluyen microangiopatía trombótica (MAT), hiperplasia intimal fibrosa y atrofia cortical focal [2, 3].
Aunque se reconoce la NASAF, la MAT renal, una característica distintiva de esta entidad, no se incluye en los criterios diagnósticos del SAF según la clasificación de Sapporo [2, 3]. Sin embargo, los esfuerzos para caracterizar mejor la NASAF llevaron a su inclusión en los nuevos criterios de clasificación ACR/EULAR para el SAF [2, 3].
Fisiopatología
La fisiopatología exacta de la NASAF aún no se comprende completamente. Sin embargo, la evidencia sugiere que los anticuerpos antifosfolípidos (aFL), en particular los dirigidos contra la β2-glicoproteína I, juegan un papel fundamental [4]. Se cree que los aFL interactúan con las células endoteliales, las plaquetas y el sistema del complemento, promoviendo un estado protrombótico e inflamatorio dentro del riñón [5].
- Activación del complemento: Estudios recientes indican que la activación del complemento podría ser un factor clave en el desarrollo de la MAT aguda en la NASAF [5, 6]. Se ha observado que los aFL pueden activar la vía clásica del complemento, lo que conduce al daño endotelial y la formación de trombos microvasculares [6].
- Factor tisular: Los aFL también pueden inducir la expresión del factor tisular en las células endoteliales, promoviendo aún más la coagulación y la trombosis [4].
- Vía mTORC: La activación de la vía mTORC, una vía de señalización implicada en el crecimiento y la proliferación celular se han relacionado con el desarrollo de lesiones vasculares crónicas en la NASAF, como la hiperplasia intimal fibrosa [4].
Hallazgos Histológicos
El diagnóstico definitivo de la NASAF se basa en el examen histopatológico de una biopsia renal. Los hallazgos clave incluyen:
- MAT: Caracterizada por la presencia de trombos de fibrina en glomérulos y arteriolas, a menudo con la presencia de fragmentos de eritrocitos [5, 7]. La MAT en la NASAF generalmente carece de infiltración inflamatoria significativa o depósitos de complejos inmunes, lo que la distingue de la nefritis lúpica [2, 3].
- Hiperplasia intimal fibrosa: Engrosamiento de la íntima de las arterias interlobulares, creando una apariencia en “piel de cebolla” [2, 4]. Esta lesión puede progresar a la oclusión del lumen, lo que lleva a isquemia y atrofia cortical focal [4].
- Trombosis recanalizada: Se pueden observar trombos organizados y recanalizados en arterias y arteriolas, lo que sugiere episodios previos de trombosis [2, 4].
- Atrofia cortical focal: Áreas de atrofia cortical con glomérulos densamente agrupados, que resultan de la reducción crónica del flujo sanguíneo debido a la oclusión vascular [2, 4].
- “Tiroidización” tubular: Los túbulos pueden mostrar una apariencia similar al tejido tiroideo debido a la atrofia tubular y la fibrosis intersticial, lo que indica un daño isquémico crónico [1, 2].
Tratamientos Disponibles
El tratamiento de la NASAF sigue siendo un desafío, ya que no existen directrices basadas en la evidencia. Las opciones terapéuticas actuales se basan en gran medida en la opinión de expertos y los datos de estudios pequeños o reportes de casos.
- Anticoagulación: La anticoagulación con heparina o warfarina es la piedra angular del tratamiento, destinada a prevenir más eventos trombóticos [4, 8]. Sin embargo, la intensidad y la duración óptimas de la anticoagulación en la NASAF no están claras, y algunos pacientes pueden experimentar eventos trombóticos a pesar de una anticoagulación adecuada [5, 8].
- Eculizumab: El eculizumab, un inhibidor del complemento, ha mostrado resultados prometedores en el tratamiento de la MAT asociada al SAF, incluida la NASAF, especialmente en pacientes con trasplante renal [1, 6]. El bloqueo del complemento puede ayudar a prevenir el daño endotelial y la formación de trombos microvasculares inducidos por los aFL [4].
- Rituximab: El rituximab, un anticuerpo monoclonal anti-CD20, puede considerarse en casos de NASAF refractaria a la terapia convencional [7]. La depleción de células B puede reducir la producción de aFL y modular la respuesta inmune [5, 7].
- Plasmaféresis: La plasmaféresis, un procedimiento que elimina los aFL de la circulación, se puede utilizar como terapia de rescate en casos de MAT grave o NASAF refractaria [5].
Pronóstico
El pronóstico de la NASAF es variable y depende de factores como la gravedad de la afectación renal, la presencia de otras manifestaciones del SAF y la respuesta al tratamiento [1]. Los pacientes con NASAF tienen un mayor riesgo de progresión a enfermedad renal crónica, eventos trombóticos recurrentes y muerte [1, 2].
Conclusiones
La identificación temprana y el tratamiento agresivo de la NASAF son cruciales para mejorar los resultados. Se necesitan más estudios para determinar el enfoque de tratamiento óptimo y para desarrollar biomarcadores predictivos que puedan identificar a los pacientes con mayor riesgo de progresión de la enfermedad y complicaciones.
| Referencias |
|---|
| 1. De Simone E, Sciascia S, Fenoglio R, Oddone V, Barreca A, Roccatello D. Antiphospholipid Syndrome and Kidney Involvement. Vol. 48, Kidney and Blood Pressure Research. S. Karger AG; 2023. p. 666–77 |
| 2. Xourgia E, Tektonidou MG. Antiphospholipid syndrome nephropathy: Current knowledge and unanswered questions. Clinical Immunology. 2023 Oct 1;255. |
| 3. Alpers CE. Antiphospholipid Antibodies (aPL) and Thrombotic Microangiopathy for the Diagnosis of aPL Nephropathy: You Can’t Have One Without the Other. Vol. 51, Journal of Rheumatology. Journal of Rheumatology; 2024. p. 109–111 |
| 4. Bienaimé F, Legendre C, Terzi F, Canaud G. Antiphospholipid syndrome and kidney disease. Vol. 91, Kidney International. Elsevier B.V.; 2017. p. 34–44 |
| 5. Tektonidou MG. Antiphospholipid syndrome nephropathy: From pathogenesis to treatment. Vol. 9, Frontiers in Immunology. Frontiers Media S.A.; 2018 |
| 6. Pala C, Parenti E, Vizzini G, Gianfreda D, Rossi GM. Thrombotic microangiopathy due to primary antiphospholipid syndrome: successful treatment with eculizumab. J Nephrol. 2024 May 1;37(4):1141–5 |
| 7. DKotzen ES, Roy S, Jain K. Antiphospholipid Syndrome Nephropathy and Other Thrombotic Microangiopathies Among Patients With Systemic Lupus Erythematosus. Vol. 26, Advances in Chronic Kidney Disease. W.B. Saunders; 2019. p. 376–86 |
| 8. Sciascia S, Amigo MC, Roccatello D, Khamashta M. Diagnosing antiphospholipid syndrome: “extra-criteria” manifestations and technical advances. Vol. 13, Nature Reviews Rheumatology. Nature Publishing Group; 2017. p. 548–60 |
