Inhibidores de SGLT-2 en la enfermedad glomerular

Por: Dra. Lina María León Machado
Nefróloga
Servicio de Nefrologia Hospital La Paz
Fundación para la Investigación Biomédica del Hospital Universitario La Paz (IdiPAZ)

Por: Dra. Yanieli Hernández
Nefróloga
Hospital Universitario La Paz
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT-2) son un grupo de fármacos inicialmente pautados en diabetes mellitus, que en los últimos años han revolucionado el tratamiento de la insuficiencia cardíaca, y la enfermedad renal crónica (ERC), dado que ha demostrado tener un impacto positivo en la supervivencia renal en pacientes con enfermedad renal diabética y no diabética, transformando la práctica clínica tal y como la conocíamos [1]. Su efecto en las enfermedades glomerulares ha sido reportado, y sigue siendo tema de estudio.
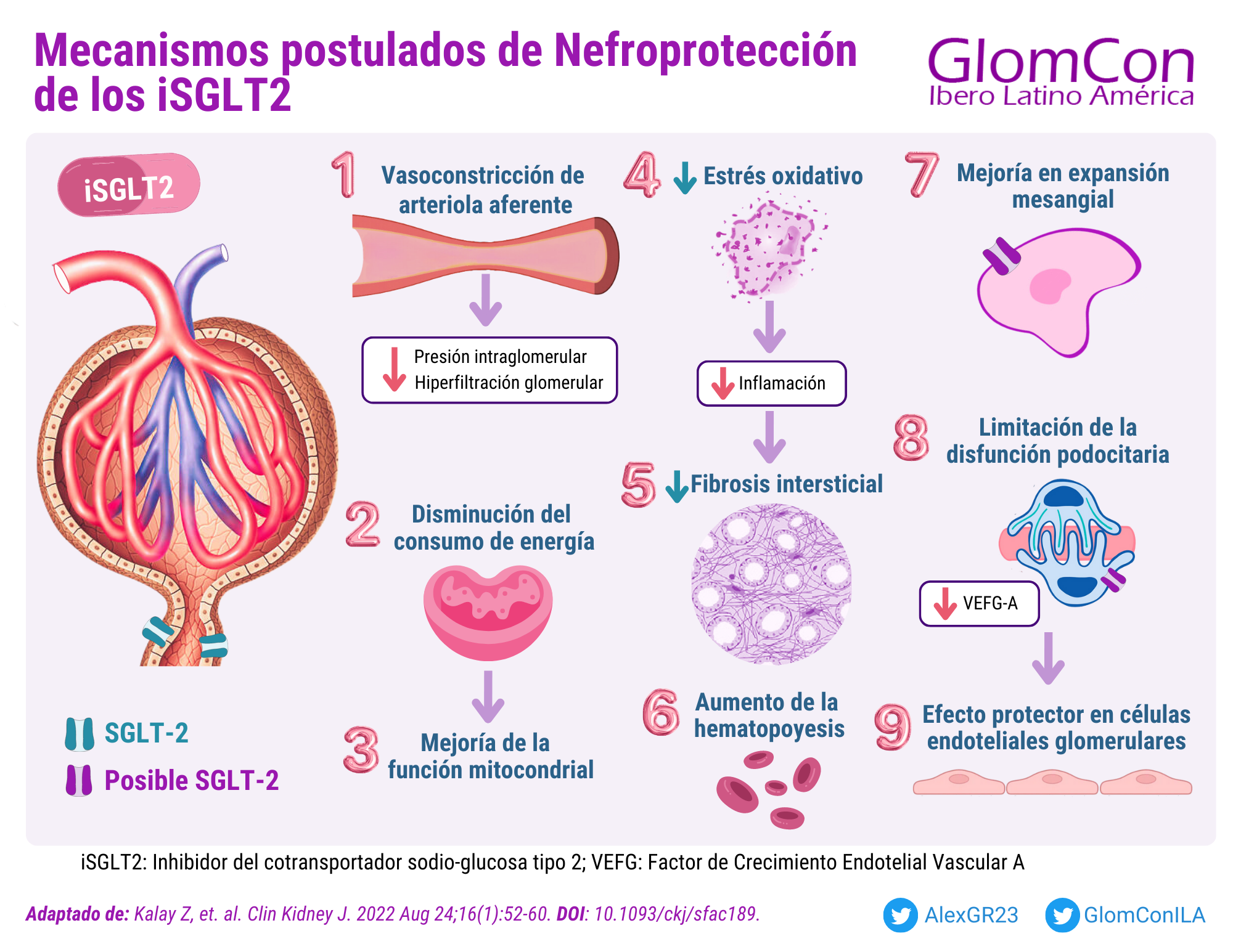
Se han propuesto múltiples mecanismos nefroprotectores. En estudios in vitro realizados en células podocitarias humanas, expuestos a altos niveles de albúmina, se ha observado un aumento de expresión de los receptores SGLT-2, el cual se ha asociado con una pérdida de estabilidad del citoesqueleto de actina y de las adhesiones focales. Dicho aumento de expresión también se ha demostrado en células mesangiales en modelos animales [2]. La inhibición del cotransportador SGLT-2 en el túbulo proximal conlleva a la reducción de la absorción de sodio y glucosa produciendo glucosuria, natriuresis, con consiguiente balance negativo, dando como resultado la disminución del volumen plasmático. Adicionalmente, se ha sugerido que podrían producir disminución en el consumo de energía, protección frente a la glucotoxicidad en las células tubulares proximales, mejoría de la función mitocondrial, aumento de la eritropoyesis, disminución del estrés oxidativo, inflamación, autofagia y disminución del daño podocitario. [3-5].

Figura 1. Mecanismos postulados de Nefroprotección de los iSGLT2.
iSGLT2: Inhibidor del cotransportador sodio-glucosa tipo 2; VEFG: Factor de Crecimiento Endotelial Vascular A
El papel de los iSGLT-2 ha sido estudiado en contexto de ERC diabética, no diabética, y en pacientes con falla cardíaca, demostrando un efecto cardio y nefroprotector. [6-8].
El estudio CREDENCE [6], en el que se utilizó Canaglifozina en pacientes diabéticos con albuminuria 300-5000 mg/g y filtrado glomerular estimado (FGe) 30-90 ml/min/1.73mc, con dosis máxima tolerada de bloqueo del sistema renina angiotensina aldosterona (SRAA), demostró una disminución de la progresión de la ERC y disminución de la muerte por causa renal y cardiovascular. Sin embargo, dicho estudio excluyó pacientes con sospecha de enfermedad renal no asociada a diabetes. Posteriormente, el estudio DAPA-CKD(7), estudió el efecto de Dapagliflozina, en pacientes diabéticos (68%) y no diabéticos (32%) con patología renal (ratio albúmina-creatinina urinaria de 200-5000 mg/g y FGe de 25-15 mL/min/1.73m2) demostrando una disminución de la progresión enfermedad rnal y muerte de causa renal o cardiovascular, independientemente de la presencia de diabetes. Más adelante, el estudio EMPA-KIDNEY(8) reafirmó los beneficios renales y cardiovasculares observados en el DAPA-CKD. En este estudio se incluyeron 6609 pacientes con ERC (eGFR: 20-45 ml/min/1.73 m2, con albuminuria ≥200 mg/g, evidenciándose una disminución de la progresión de la enfermedad renal, requerimiento de terapia renal sustitutiva y muerte de causa cardiovascular. Incluso, análisis posteriores del EMPA-KIDNEY, mostraron que los pacientes con enfermedad renal leve y albuminuria <30 mg/g también se beneficiarían del efecto nefroprotector de los iSGLT2. [1]
Pese a la escasez de ensayos clínicos publicados que demuestren un efecto beneficioso de este tipo de fármacos en el caso específico de las enfermedades glomerulares, su efecto nefroprotector se ha podido evidenciar en los ensayos descritos. En el ensayo DAPA-CKD [7], se randomizaron 695 (16.1%) pacientes con enfermedad glomerular (6.3% con nefropatía IgA (NIgA), 6.7% con glomeruloesclerosis focal y segmentaria, 2.7% con nefropatía membranosa, 0.6% con enfermedad por cambios mínimos y 6% con otras enfermedades glomerulares).
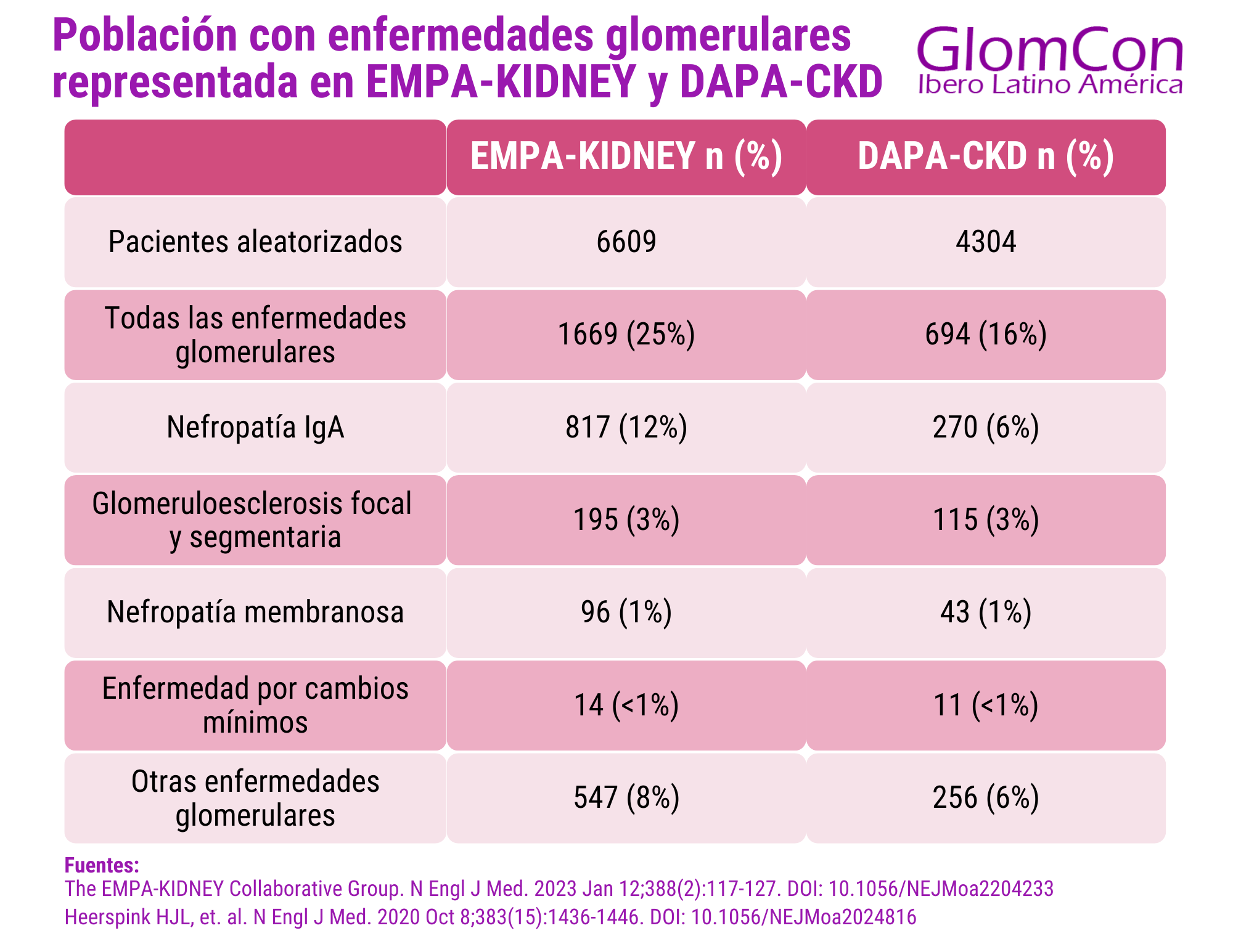
Figura 2. Efecto de iSGLT2 en la Progresión de la Enfermedad Renal en las diferentes Enfermedades Glomerulares.
GEFyS: Glomeruloesclerosis focal y segmentaria; IC: intervalo de confianza; iSGLT2: Inhibidor del cotransportador sodio-glucosa tipo 2.
El ensayo EMPA-KIDNEY [8], por su parte incluyó 1169 (25%) pacientes con enfermedad glomerular (12% con nefropatía IgA, 3% con glomeruloesclerosis focal y segmentaria, 1% con nefropatía membranosa, 0.25% con enfermedad por cambios mínimos y 8% con otras enfermedades glomerulares no especificadas. En un metaanálisis realizado por los investigadores del Nuffield Department of Population Health Renal Studies Group [9], en el que se incluye el análisis del efecto de los iSGLT2 en diferentes eventos de progresión de enfermedad renal basado en ambos ensayos, se evidenció una reducción de riesgo de progresion de enfermedad renal en enfermedades glomerulares en un 40% (Hazard ratio (HR): 0.60, Intervalo de Confianza (IC): 95%: 0.46-0.78).

Tabla 1. Población con enfermedades glomerulares representada en EMPA-KIDNEY y DAPA-CKD
En el caso de la NIgA, en un análisis preespecificado del ensayo DAPA-CKD [10], se incluyeron 270 pacientes con NIgA, con un FGe de 44 ml/min/1,73 m2 y una albuminuria media de 900 mg/gr. Los pacientes randomizados en el grupo Dapaglifozina (137), presentaron una reducción del endpoint primario compuesto (descenso sostenido en el eFG del 50% o más, ERC terminal, o muerte por causa cardiovascular o renal) (HR: 0.29, IC 95%: 0.12-0.73), con una reducción significativa del 26% de albuminuria, tras 2 años de seguimiento, comparados con el grupo placebo (133 pacientes), independientemente de la presencia de diabetes. No se observaron diferencias significativas en cuanto a eventos adversos. En el estudio de Nuffield, los iSGLT2 también se observó una reducción de los eventos de progresión de enfermedad renal en los pacientes con NIgA de ambos estudios (HR: 0.49, IC 95%: 0.32-0.74). [9]
Se sugiere que el beneficio de los iSGLT2 en la nefropatía IgA, esté basado en su mecanismo protector sobre el citoesqueleto del podocito y que este beneficio podría ser extrapolado a otras enfermedades glomerulares. Se han reportado estudios experimentales analizando los mecanismos nefroprotectores de los iSGLT2 en diferentes enfermedades glomerulares, como en la nefropatía membranosa, en la que Canaglifozina mostró un efecto inmunomodulador en modelos murinos, revirtiendo el imbalance entre linfocitos CD4+ Th1/Th2, disminuyendo la activación de las células B y de IgG, con la consecuente reducción del daño podocitario y los depósito de anticuerpos en la membrana basal glomerular. [11]
Ante la evidencia clínica favorable del uso de los iSGLT-2 en las enfermedades glomerulares en los análisis de subgrupos de estos dos ensayos clínicos, se propone su uso como parte del tratamiento conservador en algunos esquemas de manejo, como en la NIgA [12]. Por su parte, las nuevas guías KDIGO 2023, ya incluyen a los iSGLT2 como parte del tratamiento de la ERC independientemente de su etiología, añadiendo una excelente herramienta terapéutica al manejo de las enfermedades glomerulares [13].
Referencias
| 1. Beatriz Fernández-Fernandez and others, EMPA-KIDNEY: expanding the range of kidney protection by SGLT2 inhibitors, Clinical Kidney Journal, 2023; sfad082, https://doi.org/10.1093/ckj/sfad082 |
|---|
| 2. Maki T, Maeno S, Maeda Y et al. Amelioration of diabetic nephropathy by SGLT2 inhibitors independent of its glucose-lowering effect: a possible role of SGLT2 in mesangial cells. Sci Rep 2019;9:4703. https://doi.org/10.1038/s41598-019-41253-7 |
| 3. Cherney DZ, Kanbay M, Lovshin JA. Renal physiology of glucose handling and therapeutic implications. Nephrol Dial Transplant 2020;35:i3–12. https://doi.org/10.1093/ndt/gfz230 |
| 4. Kanbay M, Demiray A, Afsar B et al. Sodium-glucose cotransporter 2 inhibitors for diabetes mellitus control after kidney transplantation: review of the current evidence. Nephrology 2021;26:1007–17. https://doi.org/10.1111/nep.13941 |
| 5. Kanbay M, Ertuglu LA, Afsar B et al. Renal hyperfiltration de- fined by high estimated glomerular filtration rate: a risk factor for cardiovascular disease and mortality. Diabetes Obes Metab 2019;21:2368–83. https://doi.org/10.1111/dom.13831 |
| 6. Heerspink HJL, Oshima M, Zhang H, Li J, et al. Canagliflozin and Kidney-Related Adverse Events in Type 2 Diabetes and CKD: Findings From the Randomized CREDENCE Trial. Am J Kidney Dis. 2022 Feb;79(2):244-256.e1. https://doi.org/10.1053/j.ajkd.2021.05.005 |
| 7. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020 Oct 8;383(15):1436-1446. https://doi.org/10.1056/NEJMoa2024816 |
| 8. The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, Wanner C et al Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023 Jan 12;388(2):117-127. https://doi.org/10.1056/NEJMoa2204233 |
| 9. Nuffield Department of Population Health Renal Studies Group; SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists’ Consortium. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet. 2022 Nov 19;400(10365):1788-1801. https://doi.org/10.1016/S0140-6736(22)02074-8 |
| 10. Wheeler DC, Toto RD, Stefánsson BV, et al; DAPA-CKD Trial Committees and Investigators. A pre-specified analysis of the DAPA-CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int. 2021 Jul;100(1):215-224. https://doi.org/10.1016/j.kint.2021.03.033 |
| 11. Lv X, Wang J, Zhang L, Shao X, et al. Canagliflozin reverses Th1/Th2 imbalance and promotes podocyte autophagy in rats with membranous nephropathy. Front Immunol. 2022 Dec 1;13:993869. https://doi.org/10.3389/fimmu.2022.993869 |
| 12. Gleeson PJ, O’Shaughnessy MM, Barratt J. IgA nephropathy in adults – Treatment Standard. Nephrol Dial Transplant. 2023 Jul 7:gfad146. https://doi.org/10.1093/ndt/gfad146 |
| 13. KDIGO 2023 Clinical practice guideline for the evaluation and management of chronic kidney disease. (In review). |
